
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения элементов подгруппы меди
|
|
|
|
Соединения Сu (I), Аg (I), Аu (I). Меди и ее аналогам в степени окисления +1 отвечает электронная конфигурация d 10. Полагают, что ионы Э могут выступать не только в качестве s-акцепторов, но и p-доноров электронных пар. При этом подвижность d -электронных пар в ряду Сu (I)—Аg (I)—Аu (I) возрастает, что определяет усиление в этом ряду способности к p-дативному взаимодействию.
Как уже указывалось, степень окисления +1 наиболее характерная степень окисления серебра. У меди и в особенности у золота эта степень окисления проявляется реже. В водных растворах она в основном стабилизируется в присутствии лигандов p-акцепторного типа. Так, в растворах равновесия
2Сu+1 (р) «Сu0 (т) +Сu+2 (р) и 3Аu+1 (р) «2Аu0 (т) + Аu+3 (р)
смещаются в сторону образования производных Э (I) в присутствии, например, ионов СN- и I-.
Для меди (I) и ее аналогов наиболее характерны координационные числа 2 и 4, а для Аg (I) — также 6.
Так, кристаллы АgСN, АgSСN, АuI, ЭN3 образованы цепочками типа:
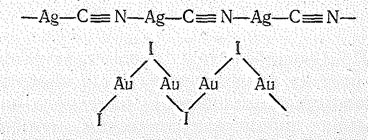
| В кристаллах Сu2O и Аg2О имеет место линейнотетраэдрическая координация атомов, в галогенидах СuНаl координационное число меди равно 4 (структурный тип сфалерита, и галогенидах АgНаl координационное число серебра равно 6 (структурный тип NaCl). |
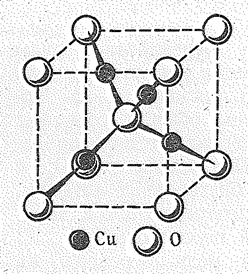
| Рис. 1. Кристаллическая структура куприта Cu2O. |
Бинарные соединения Сu (I), Аg (I) и Аu (I) твердые кристаллические солеподобные вещества, в большинстве нерастворимы в воде. Производные Аg (I) образуются при непосредственном взаимодействии простых веществ, а Сu (I) и Аu (I) при восстановлении соответствующих соединений Сu (II) и Аu (III). Из солей кислородсодержащих кислот и Э (I) относительно более устойчивы производные серебра (растворимые в воде АgNО3, АgСlО4, АgСlО3, плохо растворимые Аg2SО4, Аg2СО3 и др.).
|
|
|
Для Э (I) аквокомплексы малостойки и кристаллогидраты не характерны, но для Сu (I) и Аg (I) устойчивы амминокомплексы типа [Э(NН3)2]+. Поэтому большинство соединений Сu (I) и Аg (I) довольно легко растворяется в присутствии аммиака, например:
СuСl (т) + 2Н3N (р) = [Сu(NН3)2] Сl (р)
Аg2О (т) + 4Н3N (р) + Н2O (ж) = 2[Аg(Н3N)2](ОН) (р)
Гидроксиды типа [Э(NН3)2](ОН) значительно устойчивее, чем ЭОH, и по силе приближаются к щелочам. Это объясняется уменьшением поляризующего действия катиона Э+ на ионы ОН- за счет экранирования молекулами аммиака.
Гидроксиды ЭОН неустойчивы. При попытке их получения по обменным реакциям выделяются оксиды Сu2О (красный), Аg2О (темно-коричневый), например:
2АgNО3 (р) + 2NаОН (р) = Аg2О (т) + 2NаNО3 (р) + Н2О (ж)
Кислотная природа бинарных соединений Э (I) проявляется при взаимодействии с соответствующими основными соединениями. При этом образуются различного рода купраты (I), аргентаты (I) и аураты (I). Так, Э2O несколько растворимы в концентрированных растворах щелочей:
Сu2O (т) + 2NаОН (р) + Н2О (ж) = 2Nа[Сu(ОН)2] (р)
Нерастворимые в воде и кислотах галогениды ЭНаl довольно значительно растворяются в крепких растворах галогеноводородных кислот или основных галогенидов:
СuСl (т) + НСl (р) = Н[СuСl2] (р)
АgI (т) + КI (р) = К[АgI2] (р)
Аналогично ведут себя нерастворимые в воде цианиды ЭСN, сульфиды Э2S и пр. Из подобных реакций большое значение имеет реакция растворения галогенидов серебра в растворах тиосульфата натрия
АgВr (т) + 2Nа2S2О3 (р) = Nа3[Аg(S2О3)2] (р) + NаВr (р)
 Эта реакция имеет место при закреплении фотоматериалов гипосульфитом.
Эта реакция имеет место при закреплении фотоматериалов гипосульфитом.
Из комплексов Э (I) наиболее устойчивы цианидные производные:
Повышение устойчивости в указанном ряду можно объяснить усилением p-дативного взаимодействия М—СN.
Так же можно объяснить повышение устойчивости галогенокомплексов в ряду:
и уменьшение растворимости галогенидов в ряду ЭF—ЭСl—ЭВr—ЭI:
|
|
|
 Большинство соединений меди (I) и золота (I) легко окисляется (даже молекулярным кислородом воздуха), переходя в устойчивые производные соответственно Сu (II) и Аu (III), например:
Большинство соединений меди (I) и золота (I) легко окисляется (даже молекулярным кислородом воздуха), переходя в устойчивые производные соответственно Сu (II) и Аu (III), например:
4Сu+1Сl (т) + O2 (г) + 4НСl (р) = 4Сu+2Сl2 (р) + 2Н2O (ж)
Для соединений Сu (I) и Аu (I) характерные также реакции диспропорционирования:
2Сu+1Сl (т) «Сu0 (т) + Сu+2Сl2 (р)
3Аu+1Сl (т) + КСl (р) = К[Аu+3Сl4] (р) + 2Аu0 (т)
Большинство соединений Э (I) при небольшом нагревании и при действии света легко распадается. Поэтому их обычно хранят в банках из темного стекла. Светочувствительность галогенидов серебра используется для приготовления светочувствительных эмульсий. Важное значение имеет АgNО3, из которого получают все остальные производные серебра. Оксид меди (I) применяют для окрашивания стекла, эмалей, а также в полупроводниковой технике.
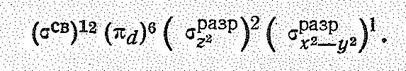 Соединения Сu (II). Степень окисления +2 характерна только для меди. Максимальное координационное число Сu (II) равно 6, что соответствует октаэдрическим комплексам (структурным единицам) следующей электронной конфигурации:
Соединения Сu (II). Степень окисления +2 характерна только для меди. Максимальное координационное число Сu (II) равно 6, что соответствует октаэдрическим комплексам (структурным единицам) следующей электронной конфигурации:
Поскольку на 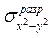 -орбитали (в отличие от
-орбитали (в отличие от 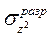 ) имеется только один электрон, связь Сu-лиганд за счет
) имеется только один электрон, связь Сu-лиганд за счет 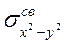 -электронов прочнее, чем за счет
-электронов прочнее, чем за счет 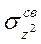 -электронов. Иными словами, четыре лиганда в плоскости ху связаны с атомом Сu прочнее, чем два лиганда, расположенные по оси z. Поэтому расстояние между атомами Сu и лигандами в плоскости ху короче, чем между атомом Сu и лигандами, расположенными по оси z, например в кристалле СuСl2:
-электронов. Иными словами, четыре лиганда в плоскости ху связаны с атомом Сu прочнее, чем два лиганда, расположенные по оси z. Поэтому расстояние между атомами Сu и лигандами в плоскости ху короче, чем между атомом Сu и лигандами, расположенными по оси z, например в кристалле СuСl2:
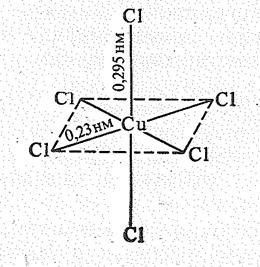
Иногда это различие столь велико, что комплексы Сu (II) можно рассматривать как квадратные. Таким образом, чаще всего встречаются соединения, в которых координационное число меди равно четырем (квадрат) и шести (искаженный октаэдр).
Для меди (II) характерны как катионные, так и анионные комплексы. Так, при растворении солей Сu (II) в воде или при взаимодействии СuО (черного цвета) и Сu(ОН)2 (голубого цвета) с кислотами образуются голубые аквокомплексы [Сu(ОН2)6]2+. Такую же окраску имеет большинство кристаллогидратов, например Сu(NO3)2×6Н2O.
В медном купоросе СuSO4×5Н2O вокруг Сu (II) координированы четыре молекулы воды в плоскости и две SO42--группы по оси. Пятая молекула Н2O играет роль мостика, объединяющего водородными связями молекулы Н2O в плоскости и SO42—группу (рис. 2):
|
|
|
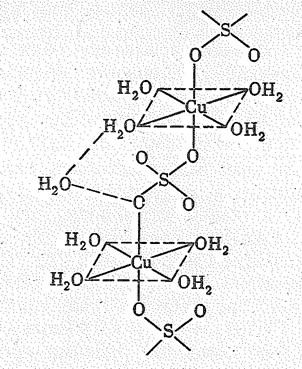 Рис. 2. Рис. 2.
|
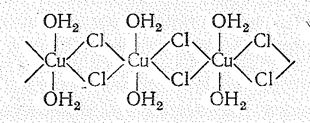 Рис. 3.
Рис. 3.
|
Часть молекул воды играет роль мостика и в других кристаллогидратах с нечетным числом молекул воды (NiSО4×7Н2O, FеSO4×7Н2O).
Встречаются также кристаллогидраты Сu (II), имеющие зеленую и темно-коричневую окраску. В этом случае кроме молекул воды роль лигандов играют соответствующие анионы. Так, в зеленом СuСl2×2Н2O атомы Сu окружены двумя молекулами воды и четырьмя атомами хлора (рис. 3).
При прибавлении воды СuСl2×2Н2O меняет окраску до голубой, т. е. при этом происходит образование аквокомплекса [Сu(OН2)6]2+.
Гидролиз солей Сu (II) часто сопровождается образованием малорастворимых в воде основных солей состава Сu(NO3)2×3Сu(ОН)2, СuSO4×2Сu(ОН)2, СuСl2×3Сu(ОН)2. Их можно рассматривать как производные оловых катионных комплексов. Большинство из этих соединений встречается в виде минералов.
Из других катионных комплексов меди (II) очень характерны комплексы с азотсодержащими лигандами, например [Сu(NН3)4(ОН2)2]2+ и хелатный [Сu(еn)2(ОН2)2]2+, константы нестойкости которых соответственно равны 1×10-13 и 3×10-21. Образованием аммиакатов, в частности, объясняется растворение Сu(ОН)2 в водных растворах аммиака:
Сu(ОН)2 (т) + 4NН3 (р) + 2Н2O (ж) = [Сu(NН3)4(ОН2)2](ОН)2 (р)
Замена в аквокомплексе [Сu(ОН2)6]2+ молекул воды на азотсодержащие лиганды приводит к появлению более интенсивной синей окраски:
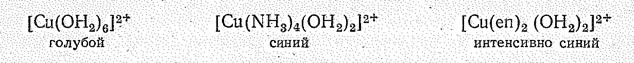 Это изменение цвета обязано усилению поля лигандов в ряду ОН2—NН3—еn, вызывающему смещение полосы поглощения из далекой красной в среднюю красную область спектра. (Максимум поглощения иона [Сu(OН2)6]2+ наблюдается при ~800 нм, а у [Сu(NН3)4(ОН2)2]2+ при 600 нм). С другой стороны, СuSO4 бесцветен, так как поле иона SО42- настолько слабое, что d — d -переходу отвечает поглощение в инфракрасной области.
Это изменение цвета обязано усилению поля лигандов в ряду ОН2—NН3—еn, вызывающему смещение полосы поглощения из далекой красной в среднюю красную область спектра. (Максимум поглощения иона [Сu(OН2)6]2+ наблюдается при ~800 нм, а у [Сu(NН3)4(ОН2)2]2+ при 600 нм). С другой стороны, СuSO4 бесцветен, так как поле иона SО42- настолько слабое, что d — d -переходу отвечает поглощение в инфракрасной области.
Соединения Сu (II) в общем устойчивее, чем однотипные производные Сu (I). Так, Сu(ОН)2 распадается на СuО и Н2O лишь при нагревании; разложение СuF2 и СuСl2 на СuНаl и Наl2 начинается соответственно при 950 и 500 °С. Однако СuI2 (DG0 = —8,2 кДж/моль) разлагается уже при обычных температурах, переходя в СuI (DG0 = —71 кДж/моль). Поэтому при попытке получения СuI2 по обменной реакции протекает окислительно-восстановительная реакция -
|
|
|
2Сu2+ (р) +4I- (р) = 2СuI (т) + I2 (т)
Аналогичным образом неустойчивы Сu(СN)2 и Сu(SСN)2:
2СuSО4 (р) + 4КСN (р) = 2СuСN (т) + (СN)2 (г) + 2К2SO4 (р)
Для меди (II) характерны также анионные комплексы купраты (II). Так, Сu(ОН)2 при нагревании в концентрированных растворах щелочей частично растворяется, образуя синие гидроксокупраты (II) типа М+12[Сu(ОН)4]. Некоторые из них выделены в свободном состоянии. В водных растворах гидроксокупраты (II) легко разлагаются, что свидетельствует о слабости кислотных свойств Сu(ОН)2.
В избытке основных галогенидов СuНаl2 образуют галогенокупраты (II) типа M+1[СuНаl3] и М+12[СuНаl4]. В отличие от Сu(СN)2 вполне устойчивы и хорошо растворимы в воде цианокупраты (II) типа М+12[Сu(СN)4]. Анионные комплексы Сu (II) ивестны также с карбонат-, сульфат- и другими анионами. Так, выделен темно-синий карбонатокупрат (II) калия К3[Сu(СO3)2]. Из растворов сульфатов щелочных металлов СuSO4 кристаллизуется в виде М1+2Сu(SO4)2×6Н2О.
Из производных серебра (II) более или менее устойчивы АgF2 и некоторые комплексные соединения с органическими лигандами. Соединения золота (II) неизвестны.
Из соединений меди (II) технически наиболее важен кристаллогидрат СuSО4×5Н2O (медный купорос). Он применяется для получения минеральных красок, для борьбы с вредителями и болезнями растений в сельском хозяйстве, служит исходным продуктом для получения меди и ее соединений и т. д.
Соединения Сu (III), Аg (III), Аu (III). Степень окисления + З наиболее характерна для золота. Диамагнетизм соединений золота (III) согласуется с участием в образовании связей 5 d 6 s 6 р 2-орбиталей иона Аu3+ (d 8):
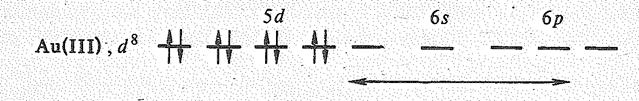 Это отвечает квадратной конфигурации комплексов и структурных единиц соединений золота (III).
Это отвечает квадратной конфигурации комплексов и структурных единиц соединений золота (III).
Из бинарных соединений Аu (III) известны:
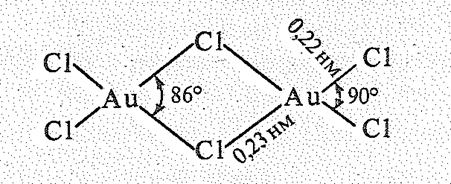
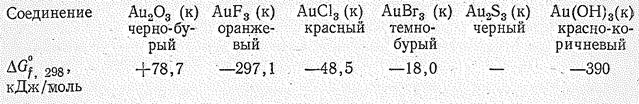 В воде растворимы лишь АuСl3 и АuВr3, состоящие из димерных плоских молекул:
В воде растворимы лишь АuСl3 и АuВr3, состоящие из димерных плоских молекул:
Основным исходным продуктом для получения других соединений золота является АuСl3, который получают взаимодействием порошка Аu с избытком Сl2 при 200 °С.
Галогениды, оксид в гидроксид Аu (III) — амфотерные соединения с преобладанием кислотных признаков. Так, Аu(ОН)3 легко растворяется в щелочах, образуя гидроксоаураты (III):
NаОН + Аu(ОН)3 = Nа[Аu(ОН)4]
Даже растворение в кислотах Аu(ОН)3 происходит за счет образования анионных комплексов:
Аu(ОН)3 + 4НNO3 = Н[Аu(NО3)4] + 3Н2O
Нитрато- и цианоаураты (III) водорода выделены в свободном состоянии. В присутствии солей щелочных металлов образуются нитрато-М+1[Аu(NO3)4], сульфато-М+1[Аu (SO4)2], циано-М+1 [Аu (СN)4], сульфидо-М+1[АuS2] и другого типа аураты (III).
Кислотный характер галогенидов Аu (III) проявляется в их исключительной склонности давать галогеноаураты (III) М+1[АuНаl4] (константа нестойкости иона [АuСl4]- равна 5×10-22). Большинство галогеноауратов (III) хорошо растворимо в воде и органических растворителях.
Особая склонность Аu (III) к образованию анионных комплексов проявляется и при гидролизе его тригалогенидов:
АuСl3 + Н2O «Н[Аu(ОН)Сl3]
АuСl3 + Н2O «Н2[АuOСl3]
Образующаяся при этом кислота Н2[АuОСl3] с ионами Аg+ дает труднорастворимую соль Аg2[АuОСl3], а не АgСl, что указывает на большую устойчивость иона [АuОСl3]2-.
Для Сu (III) и Аg (III) известны фторопроизводные: синий К3[СuF6] и желтый К[АgF4]. При окислении Сu(ОН)2 в щелочной среде получаются гидроксо- и оксокупраты (III) типа КСuО2 и К[Сu(OН)4]:
2Сu+2(ОН)2 + NaClO + 2NаОН = 2NаСu+3О2 + NаСl + 3Н2O
Степень окисления +3 у меди и серебра стабилизируется в комплексных иодатах (VП) и теллуратах (VI), например К7[Сu(IО6)2]×7Н2O, Nа9[Сu(ТеО6)2] (коричневого цвета) и К6Н[Аg(IО6)2]×10Н2O, Nа6Н3[Аg(ТеО6)2]×20Н2О (желтого цвета). Соединения Сu (III) и Аg (III) — сильные окислители.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1866; Нарушение авторских прав?; Мы поможем в написании вашей работы!