
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цепные реакции
|
|
|
|
Лекция №5.
Теория цепных реакций разрабатывалась Нернстом, Боденштейном, Хиншелвудом, Н.Н. Семеновым.
Цепными называются реакции, протекающие с участием химически активных веществ или частиц (свободных радикалов) и состоящих из большого количества повторяющихся стадий. К ним относятся сгорание топлива, окисление углеводородов, галогенирование углеводородов, многие случаи полимеризации, крекинг тяжелых нефтепродуктов и другие реакции.
Пример: хлорирование водорода
Cl2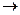 Cl°+Cl° Зарождение цепи
Cl°+Cl° Зарождение цепи
H2 +Cl°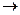 HCl + H° Развитие цепи
HCl + H° Развитие цепи
H°+ Cl2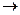 HCl + Cl°
HCl + Cl°
Сl°+ H2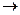 HCl + H°
HCl + H°
H°+ Cl2 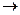 HCl + Cl°
HCl + Cl°
.............................
H°+ H°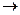 H2 Обрыв цепи
H2 Обрыв цепи
Cl°+ Cl°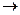 Cl2
Cl2
H°+ Cl°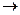 HCl
HCl
Длина цепи − это число молекул данного исходного вещества, прореагировавших в результате единого акта зарождения цепи. Может быть от 2 до десятков тысяч.
Реакции зарождения цепи могут протекать по следующим причинам:
1) в результате термической диссоциации
Cl2 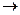 Cl°+Cl°;
Cl°+Cl°;
2) под действием света
Сl2 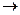 Cl°+ Cl°
Cl°+ Cl°
3) на поверхности катализатора (Pt)
H2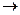 H°+ H΄°
H°+ H΄°
4) под действием инициаторов
Сl2 +Na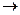 NaCl+Cl°
NaCl+Cl°
5) под действием электрического разряда
6) под действием других причин
Обрыв цепи может происходить по следующим причинам:
1) в результате тройных соударений
Cl°+Cl°+M Cl2+M*,
Cl2+M*,
где М − третья молекула, она уносит избыточную энергию. В качестве третьей молекулы может служить стенка сосуда, этим объясняется влияние размеров и формы сосуда на скорость реакции.
2) под действием ингибиторов
CH3°+ NO  HCN + H2О
HCN + H2О
3) путем адсорбции активных частиц на поверхности реактора. Этим объясняется влияние материала стенок реактора на скорость реакции.
Цепные реакции делятся на неразветвленные, в ходе которых число активных частиц не увеличивается и разветвленные в которых в ходе развития цепи число активных частиц увеличивается.
|
|
|
Пример: реакция горения водорода
2H2 + O2  2H2О
2H2О
 -схема разветвленной цепной реакции
-схема разветвленной цепной реакции
Зависимость скорости разветвленной цепной реакции от давления имеет следующий вид
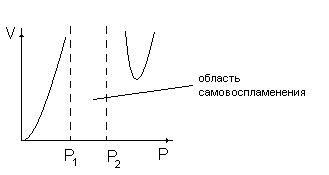
При Р ‹ Р2 активные частицы гибнут на стенках
При Р › Р2 активные частицы гибнут в результате тройных соударений.
В интервале Р1 ‹ Р ‹ Р2 реакция протекает с большой скоростью.
Р1 и Р2 называются нижним и верхним пределом самовоспламенения (взрываемости), они могут зависеть от температуры. Кинетические уравнения цепных реакций обычно выводят с помощью метода квазистационарных концентраций Боденштейна. Они имеют приближенный характер, а также различный вид для различных частных случаев.
Например: для реакции хлорирования метана кинетическое уравнение зависит от преобладающей реакции обрыва цепи
Cl°+Cl°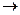 Cl2
Cl2

CH3°+CH3°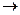 C2Н6
C2Н6

Cl°+стенка

CH3°+Cl°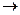 CH3Cl
CH3Cl

Более точное описание хода реакции можно получить, решая систему дифференциальных кинетических уравнений для каждой стадии реакции.
Признаки протекания реакции по цепному механизму:
1) Скорость реакции может быть значительно увеличена при добавлении очень малого количества некоторых веществ называемых инициаторами, либо при воздействии физических агентов (света ионизирующих излучений), способствующих образованию свободных радикалов.
2) Скорость реакции может быть значительно уменьшена при добавлении очень малого количества веществ, называемых ингибиторами (веществ, увеличивающих вероятность обрыва цепи)
3) Скорость реакции при малых давлениях сильно зависит от формы и размеров реактора и материала стенок. В длинной узкой трубе активные частицы долетают до стенок и гибнут.
Активные частицы, образующиеся в ходе реакции могут быть обнаружены физико−химическими методами анализа.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!