
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №6. Кинетика гетерогенных процессов
|
|
|
|
 Кинетика гетерогенных процессов.
Кинетика гетерогенных процессов.
Гетерогенными называются реакции, протекающие на поверхности раздела фаз. Примеры: испарение, кристаллизация, растворение газа или твердого вещества в жидкости, горение твердого вещества или жидкого топлива, окисление металлов и другие процессы.
Скорость гетерогенных процессов - это величина, равная:

Гетерогенный процесс состоит из следующих стадий:
1. Подвод исходных веществ к поверхности раздела фаз (диффузия).
2. Переход вещества через границу раздела фаз или химическая. реакция на поверхности.
3. Отвод от поверхности продуктов реакции.
Пример: 

Скорость суммарного процесса определяется наиболее медленной стадией.
Различают следующие случаи:
1) <<
<< - говорят, реакция протекает в кинетической области (в кинетическом режиме);
- говорят, реакция протекает в кинетической области (в кинетическом режиме);
2)  <<
<< - реакция протекает в диффузионной области;
- реакция протекает в диффузионной области;
3)  ≈
≈ - реакция протекает в переходной области.
- реакция протекает в переходной области.
Диффузия – это процесс переноса вещества, в результате которого происходит выравнивание концентрации.
Первый закон Фика.

где dm – масса вещества переносимого за время dt через поверхность, перпендикулярную диффузионному потоку площадью S в направлении диффузионного
потока; D – коэффициент диффузии;  - градиент концентрации. Если направление оси х выбрано в направлении диффузионного потока, то
- градиент концентрации. Если направление оси х выбрано в направлении диффузионного потока, то  <0, dm>0.
<0, dm>0.
С ростом температуры скорость диффузии увеличивается. Коэффициент диффузии равен  , здесь Еd- энергия активации диффузионного процесса, она обычно значительно меньше чем энергия активации реакции. Поэтому с ростом температуры скорость диффузии растет медленнее, чем скорость реакции. Если при некоторой температуре процесс протекал в кинетической области (
, здесь Еd- энергия активации диффузионного процесса, она обычно значительно меньше чем энергия активации реакции. Поэтому с ростом температуры скорость диффузии растет медленнее, чем скорость реакции. Если при некоторой температуре процесс протекал в кинетической области ( <<
<<  ) то при повышении температуры процесс может перейти в диффузионную область (
) то при повышении температуры процесс может перейти в диффузионную область ( <<
<< ).
).
|
|
|
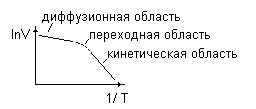
Скорость диффузии может быть увеличена путем искусственного перемешивания (конвективная диффузия).
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 343; Нарушение авторских прав?; Мы поможем в написании вашей работы!