
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Движение постоянного электрического тока через живые объекты
|
|
|
|
Осмос
В растворе помимо молекул растворённого вещества присутствуют и молекулы растворителя. Что будет, если мембрана между отсеками будет непроницаема для молекул растворённого вещества, но будет пропускать молекулы растворителя?
Рассмотрим простую модель – два отсека, разделённые мембраной, способной пропускать молекулы растворителя, например, воды и непроницаемой для молекул растворённых веществ. Для наглядности в первом отсеке концентрация растворённого вещества высокая, а во втором низкая. Выделим в каждом отсеке одинаковые объёмы.
Если записать для каждого отсека электрохимический потенциал молекул растворителя, то сразу становится очевидным, что электрохимический потенциал молекул растворителя в первом отсеке меньше, чем во втором, а это означает, что молекулы растворителя будут двигаться из второго отсека в первый. В реальном эксперименте с осмометром это выглядит, как будто какая-то сила заставляет молекулы растворителя двигаться в сторону большей концентрации растворённого вещества. Это явление - движение молекул растворителя через полупроницаемую мембрану в сторону большей концентрации растворённого вещества называется осмосом, а сила, которая заставляет молекулы воды двигаться – это и есть осмотическое давление.
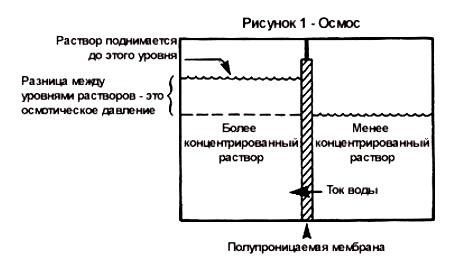
Осмотическое давление раствора зависит от количества растворенных ионов и температуры. В соответствии с уравнением Вант-Гоффа осмотическое давление (π) раствора прямо пропорционально концентрации (С) растворенного вещества и абсолютной температуре раствора (T):
π = iRTC,
где i - изотонический коэффициент, зависящий от степени диссоциации электролита и показывающий, во сколько раз увеличивается количество растворенных частиц при диссоциации молекул; для неэлектролитов i = l, для электролитов i > 1; R - газовая постоянная.
|
|
|
Активный транспорт - движение против градиента электрохимического потенциала, осуществляемое с затратой химической энергии за счёт гидролиза АТФ или переноса электрона по дыхательной цепи.
Выделяют первично-активный и вторично-активный транспорт.

| ||
| Кальциевый насос | Натриевый насос | Протонная помпа |
Рис. - Активный перенос ионов при работе транспортных АТФ-аз.
Транспорт называется первично-активным, если он осуществляется белками-переносчиками (они ещё называются ионными насосами), источником энергии для которых служат АТР, пирофосфат или субстраты, окисляемые в электрон-транспортных цепях митохондрий, хлоропластов.
Типичный пример первично-активного транспорта - активный транспорт ионов с помощью АТФ-аз.
Вторично-активным (сопряженным) транспортом называют процесс переноса ионов через мембрану против градиента его концентрации за счет энергии электрохимического градиента других ионов. Сопряженный транспорт может осуществляться в режиме симпорта (оба иона переносятся через мембрану в одном направлении) или антипорта (ионы транспортируются в противоположных направлениях). Вторично-активный транспорт обеспечивает мембранный перенос моносахаридов, сахарозы, аминокислот, пептидов, анионов и ряда катионов. Для этой цели мембранные белки-переносчики чаще всего используют электрохимический градиент ионов водорода, создаваемый различными Н+-насосами.

Рис. - Сопряженный транспорт ионов и веществ через мембраны (Δφ - разность потенциалов, ΔрН - разность концентрации протонов)
Между пассивными и активными потоками в клетке существует взаимодействие, направленное на поддержание постоянства ионного состава клетки.
|
|
|
При блокировании энергетики клетки (пониженной температурой, ингибиторами, темнотой) интенсивность активного транспорта снижается, приток ионов из внешней среды уменьшается. Одновременно наблюдается возрастание электрического сопротивления мембраны в десятки раз. Это свидетельствует об уменьшении транспорта ионов по пассивным каналам, что предотвращает потерю ионов, находящихся в клетке.
Поставим эксперимент. Пропустим постоянный электрический ток через сопротивление и зарегистрируем изменение тока во времени. Мы получим кривую, показанную на рисунке 1 (1): ток через сопротивление R будет оставаться постоянным в течение времени.
| I |
| I = const (1) |
| I = f(t) (2) |
| t |
Рисунок 1 - Изменение силы тока при прохождении через обычный полупроводник (1) и через живую ткань (2)
Теперь поместим живую ткань в металлические электроды и пропустим через неё ток и будем измерять изменение его величины. Мы получим кривую (2): величина тока со временем будет уменьшаться.
Чтобы разобраться в причинах такого изменения тока, рассмотрим движение ионов в растворе.
До приложения тока наблюдается объёмная электронейтральность раствора – в единице объёма раствора содержится одинаковое количество положительных и отрицательных зарядов. После приложения тока к электродам, опущенным в раствор, начинается поляризация: движение заряженных частиц к противоположно заряженному электроду и их разделение. Это приводит к образованию электродвижущей силы (ЭДС), направленной в противоположную сторону по отношению к приложенному напряжению. Эта сила называется ЭДС поляризации, и, учитывая её, уравнение закона Ома можно записать в виде:
где E(t) - ЭДС поляризации, меняющаяся со временем;
Ещё одной причиной изменения силы тока в растворах связано с тем, что некоторые металлы могут в растворе подвергаются электрохимическому окислению, при этом заряд переходит на электрод, и степень поляризации снижается. Поэтому в биологических исследованиях очень часто используют хлорсеребряные электроды, которые практически не поляризуются при слабых токах.
Но даже если использовать неполяризующиеся электроды, всё равно наблюдается поляризация – она обусловлена гетерогенностью живых тканей и, в первую очередь, наличием мембранных структур.
|
|
|
Высокая поляризационная ёмкость – характерное свойство живых, неповреждённых клеток.
Разрушение тканей резко усиливает ток через них. На этом основан способ определения морозоустойчивости.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 516; Нарушение авторских прав?; Мы поможем в написании вашей работы!