
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция вторая
|
|
|
|
Вывести сами уравнения состояния на основе начал ТД нельзя. Для каждой конкретной системы они определяются эмпирически, т.е. берутся из опыта, или находятся методами статистической физики. Так что в рамках ТД они считаются заданными при определении системы.
До сих пор не существует удовлетворительной общей теории уравнений состояния, кроме случаев особых простых систем: идеального газа и совершенных кристаллов. Для жидкостей и твердых тел соотношения между параметрами состояния до сих пор получают эмпирически.
Ограничимся рассмотрением простых систем, систем с постоянным числом частиц, состояние которых определяется только одним внешним параметром и температурой.
Термическое уравнение состояния такой системы, записанное в общем виде:
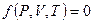 .
.
Калорическое уравнение состояния, записанное в общем виде:
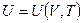 .
.
Например:
для идеального газа уравнение состояния (термическое) - это уравнение
Менделеева-Клапейрона 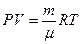 ;
;
для модели реального газа уравнение состояния - это уравнение Ван-дер-Ваальса
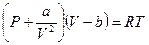 - для одного моля вещества.
- для одного моля вещества.
Если известны два параметра, то третий находится из уравнения состояния
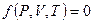 .
.
Например: 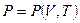 ,
,  ,
, 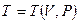 .
.
Уравнение состояния изображается в условном пространстве 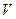 ,
, 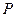 ,
, 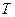 поверхностью состояний. Каждой точке такой поверхности соответствует определенное состояние данной системы, и наоборот, точке не лежащей на поверхности не соответствует никакое состояние этой системы. Если мы отметим точками на поверхности состояний, все промежуточные состояния, в которых будет находиться система при совершении квазистатического процесса перехода из начального состояния в некоторое конечное состояние, то, полученная линия, отразит путь перехода от начального состояния в конечное. Таких путей перехода может быть бесконечное множество.
поверхностью состояний. Каждой точке такой поверхности соответствует определенное состояние данной системы, и наоборот, точке не лежащей на поверхности не соответствует никакое состояние этой системы. Если мы отметим точками на поверхности состояний, все промежуточные состояния, в которых будет находиться система при совершении квазистатического процесса перехода из начального состояния в некоторое конечное состояние, то, полученная линия, отразит путь перехода от начального состояния в конечное. Таких путей перехода может быть бесконечное множество.
В ряду параметров выделяются величины, которые так же характеризуют состояние системы и меняются с изменением состояния, т.е. зависят от 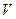 ,
, 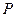 ,
, 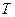 . Но эти величины, зависят только от состояния, и, не зависят от того пути, по которому система пришла в это состояние. Они дают более полные сведения о системе и называются функциями состояния.
. Но эти величины, зависят только от состояния, и, не зависят от того пути, по которому система пришла в это состояние. Они дают более полные сведения о системе и называются функциями состояния.
Величины, независящие от предыстории, а полностью определяющие состояние системы в данный момент называются функциями состояния, т.е. функциями 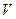 ,
, 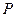 ,
, 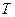 .
.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 249; Нарушение авторских прав?; Мы поможем в написании вашей работы!