
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические основы процесса ожижения газов
|
|
|
|
Установки глубокого холода.
Согласно классификаци в холодильной технологии (см. лекцию 7) к установкам глубокого холода относятся такие, в которых температура хладоагента в холодильной камере ниже 120К.
Назначение таких установок – перевести смесь веществ из газообразного состояния в жидкое. Далее, эта жидкость направляется на разделение с целью получения чистых компонент смеси. Например, природный газ ожижают для отделения ценных компонент (в частности, Не), а оставшаяся жидкая смесь углеводородов транспортируется или по трубопроводам, или в специальных сосудах Дюара на кораблях или наземным транспортом. В целом такой способ транспортировки природного газа потребителю сегодня оказался дешевле, чем трубопроводный газотранспорт.
Эти основы легко уяснить, если ответить на вопрос: «В чем отличие молекулярного состояния вещества в жидкой и газообразной фазе?». Прежде всего, ясно, что среднее расстояние l между молекулами газа много больше, чем между молекулами жидкости. Следовательно, для перевода газа в жидкость необходимо сблизить молекулы вещества, т.е. увеличить плотность ρ(р,Т), кг/м3, т.е. увеличить давление р.
Другое отличие состояния молекул вещества в газовой и жидкой фазах – большие линейные скорости поступательного хаотического движения молекул газа, это что-то около скорости звука. Следовательно, для ожижения газа необходимо не только сблизить молекулы, но и уменьшить внутреннюю энергию газа, т.е. отвести теплоту. А если этот процесс отвода теплоты изобарный (как во всяком теплообменнике), то отвод теплоты приводит к уменьшению температуры.
Итак: чтобы ожижить любой газ (или их смесь), необходимо создать высокое давление и охладить его.
|
|
|
Молекулы любого реального вещества испытывают силовое взаимодействие между собой. Это или силы отталкивания, или притяжения. На рис. 8.1 представлена зависимость этих сил от расстояния между молекулами l. Оказывается, при больших l эта сила – сила отталкивания, и она очень мала. Собственно, поэтому модель идеального газа оказалась такой работоспособной: изменение l для газов слабо меняет силу отталкивания (из-за ее малости), поэтому вклад потенциальной энергии взаимного расположения молекул во внутреннюю энергию газа ничтожен.
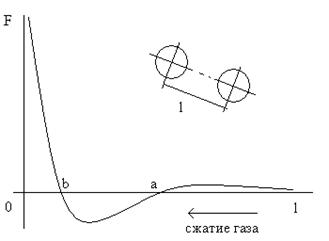
Рис. 8.1. Зависимость силы взаимодействия между молекулами от расстояния между ними.
При сжатии газа (увеличении давления) расстояние l уменьшается, а сила отталкивания сначала растет и далее уменьшается (см. рис. 8.1). При l = a эта сила становится нулевой. При дальнейшем сжатии начинает действовать сила притяжения вплоть до точки l = b. За этой точкой, левее, снова возникает сила отталкивания, которая резко растет с уменьшением l.
Можно показать, что точка l = a является неустойчивой точкой равновесия. Действительно, если расстояние между молекулами слегка увеличилось относительно l = a в силу каких-то случайных причин, то начнет действовать пусть небольшая сила отталкивания, и молекулы «разбегутся» друг от друга. Если же расстояние между молекулами чуть уменьшится относительно l = a, то начнет действовать сила притяжения, и молекулы начнут сближаться друг с другом, но не вернутся в исходное положение l = a.
Те же самые рассуждения позволяют доказать, что точка l = b является устойчивой точкой равновесия: любые малые отклонения расстояния между молекулами от l = b в конце концов приводят к появлению сил, возвращающих их в положение l = b.
Рассмотрение сил взаимодействия между молекулами вещества и точек равновесия позволяет сделать рекомендации для определения минимального расстояния между молекулами (l < a). Если расстояние l удовлетворяет указанному неравенству (т.е. такова степень сжатия газа), то все молекулы газа «прибегут» в точку устойчивого состояния равновесия l = b. Это и будет состояние жидкой фазы вещества.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 586; Нарушение авторских прав?; Мы поможем в написании вашей работы!