
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические связи кислорода
|
|
|
|
Строение и, следовательно, свойства соединений кислорода определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы.
| Тип гибридизации кислорода | Электронная конфигурация | Число гибридных орбиталей | Валентный угол |
| sp3 | 1s2(2sp3)6 
| 108,5° | |
| sp2 | 1s2(2sp2)52p1 
| 120° |
За счет двух одноэлектронных АО кислород способен к образованию двух ковалентных связей с другими атомами по обменному механизму. В этом случае кислород проявляет валентность 2 и имеет две неподеленные электронные пары. Такой атом кислорода может выступать донором пары электронов, образуя третью связь по донорно-акцепторному механизму. При этом кислород приобретает валентность 3 и заряд +1 (например, в ионе гидроксония H3O+ или алкилгидроксония RH2O+).
Такое взаимодействие кислородсодержащих соединений играет важную роль при  проведении реакций в присутствии сильных минеральных кислот в качестве катализаторов (кислотный катализ).
проведении реакций в присутствии сильных минеральных кислот в качестве катализаторов (кислотный катализ).
Положительно заряженный атом кислорода может участвовать в образовании ионной связи. Например, в хлориде метилгидроксония:
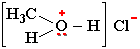
Электроотрицательности кислорода, водорода, углерода, соответственно, равны 3.5, 2.1 и 2.5. Поэтому связи кислорода с Н или С являются ковалентными полярными. В этих связях электронная плотность смещена к более электроотрицательному атому кислорода, создавая на нем частичный отрицательный заряд, а на углероде или водороде - частичный положительный.
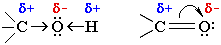
Распределение электронной плотности на атомах молекулы определяет ее реакционную способность: полярный характер связей кислорода с водородом и углеродом способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 619; Нарушение авторских прав?; Мы поможем в написании вашей работы!