
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение гидроксильной группы
|
|
|
|
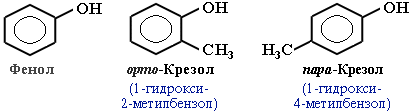
Фенолы
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
VRML-модель молекулы фенола (7241 байт)
В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
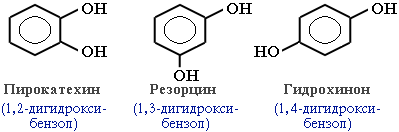
Как видно из приведенных примеров, фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:

 Дипольный момент связи С–О составляет 0,70 D, а связи О–Н – 1,51 D. Разрыв таких связей происходит преимущественно гетеролитически (по ионному механизму).
Дипольный момент связи С–О составляет 0,70 D, а связи О–Н – 1,51 D. Разрыв таких связей происходит преимущественно гетеролитически (по ионному механизму).
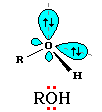
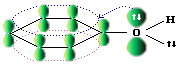
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2sp3-АО кислорода занята неподеленной парой электронов.
В фенолах под влиянием π-электронной системы бензольного кольца для атома кислорода предпочтительней sp2-гибридизация. При этом одна из неподеленных электронных пар находится на негибридной р -орбитали и может участвовать в сопряжении с ароматической π-системой.
Электронные эффекты ОН-группы. Гидроксигруппа проявляет отрицательный индуктивный эффект (–I -эффект) по отношению к углеводородному радикалу и в спиртах выступает как электроноакцепторный заместитель. В фенолах, где ОН-группа находится при sp2-атоме углерода, кроме того, она проявляет положительный мезомерный эффект (+ M), предоставляя неподеленную электронную пару кислорода в π-систему сопряжения бензольного кольца (анимация, 6 Kб). Вследствие большей подвижности p-электронов + М -эффект сильнее, чем - I -эффект, т.е. гидроксигруппа в фенолах является электронодонорным заместителем (отрицательный заряд на атоме кислорода в феноле ниже, чем в предельных одноатомных спиртах).
Сравните распределение электронной плотности (зарядов на атомах) в молекулах метанола и фенола.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1426; Нарушение авторских прав?; Мы поможем в написании вашей работы!