
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсолютна шкала температур
|
|
|
|
Фазові перетворення
При переходах речовин із одного аргегатного стану в інший, виділяється або поглинається прихована теплота. Фазові переходи розділяють на дві категорії: при фазових переходах першого роду значення термодинамічних потенціалів змінюються стрибком, при фазових переходах другого роду стрибком змінюються похідні від термодинамічних потенціалів, а самі термодинамічні потенціали залишаються неперервними функціями своїх аргументів.
Правило фаз визначає можливість співіснування різних агрегатних станів речовин. Для однокомпонентної речовини водночас може існувати максимум три фази - таке відбувається в потрійній точці. Для багатокомпонентних речовин, наприклад сплавів, одночасно може існувати більше фаз. Криві співіснування фаз задаються фазовими діаграмами.
Принцип Лешательє-Брауна стверджує те, що рівноважна термодинамічна система у відповіднь на зовнішню дію змінюється таким чином, щоб зменшити результат цієї дії. Принцип Лешательє-Брауна допомагає також при вивченні зміни рівноважного стану в системах, в яких можливі хімічні реакції.
Температурні шкали Фаренгейта і Цельсія обирали за реперні точки температури певних процесів, наприклад, температуру замерзання і кипіння води при нормальних умовах (певному значенні тиску). Потреба в точніших вимірюваннях призвела до вдосконалення температурної шкали. Існує найнижча можлива температура, яку називають абсолютним нулем температури. При температурі абсолютного нуля будь-який тепловий рух в тілах припиняється. Розроблена лордом Кельвіном температурна шкала була вибрана так, що температура потрійної точки води складала 273.16 градуса. При такій градації величина градуса Кельвіна збігається з величиною градуса Цельсія. Ця шкала температур отримала назву абсолютної. Абсолютна шкала температур використовується в наукових статтях, хоча в повсякденному житті шкала Цельсія зручніша.
|
|
|
При наближенні температури до абсолютного нуля фізичні властивості термодинамічних систем міняються. Третій закон термодинаміки (теорема Нернста) стверджує те, що при нульовій температурі ентропія термодинамічної системи має мінімальне значення, нульове для хімічно-впорядкованих систем. Нульове значення має такожтеплоємність Термодинаміка і статистична фізика
Під кінець XIX-го століття отримали підтвердження гіпотези про атомну будову речовин. Стало зрозумілим, що температура тіл пов'язана із хаотичним тепловим рухоматомів. Виникла нова область теоретичних досліджень - статистична механіка, яка дозовлила побудувати мікроскопічну атомарну теорію багатьох термодинамічних явищ. В основі статистичної механіки лежить припущення Больцмана про те, що ентропія пропорційна логарифму числа мікроскопічних станів, яким може реалізуватися даний макроскопічний стан:
 ,
,
де 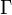 - число мікроскопічних станів, а
- число мікроскопічних станів, а 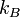 - стала пропорційності, що отримала назву сталої Больцмана.
- стала пропорційності, що отримала назву сталої Больцмана.
Статистична механіка пропонує ясний шлях знаходження термодинамічних потенціалів через величину, яка називається статистичною сумою. Проте знаходження статистичної суми для більшості систем дуже складна математична задача. Воно може бути виконане точно тільки для невеликого числа модельних систем, наприклад для ідеального газу. Знання статистичної суми дозволяє обчислити вільну енергію Гельмгольца за формулою
 ,
,
де  - абсолютна температура,
- абсолютна температура, 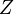 - статистична сума. Оскільки через похідні від вільної енергії виражаються всі термодинамічні змінні, то статистична сума містить повну інформацію про термодинамічну систему.
- статистична сума. Оскільки через похідні від вільної енергії виражаються всі термодинамічні змінні, то статистична сума містить повну інформацію про термодинамічну систему.
|
|
|
На початку 20 століття була відкрита квантова механіка і побудована квантова статистична фізика. Загальні термодинамічні міркування для квантової статистики та класичної статистики залишаються однаковими, проте результати дуже суттєво змінюються. Особливо це стосується принципу нерозрізнюваності частинок. Завдяки цьому принципу всі квантові частинки діляться на два класи - ферміони і бозони, для яких характерні різні статистики - статистика Фермі-Дірака та статистика Бозе-Ейнштейна, відповідно. Застосування цих квантових статистик дозволило розширити область справедливості термодинаміки на фізичні системи при дуже низьких температурах, при дуже великих густинах, наприклад, у надрах зірок, тощо.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 588; Нарушение авторских прав?; Мы поможем в написании вашей работы!