
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды коагуляции электролитами
|
|
|
|
ЛЕКЦИЯ №9
При коагуляции золя электролитами различают: концентрационную коагуляцию и нейтрализационную коагуляцию.
Концентрационная коагуляция - наблюдается в том случае, когда добавляется индифферентный электролит, это приводит к увеличению концентрации противоионов в золе, а следовательно, вызывает сжатие диффузного слоя противоионов (уменьшение “c“), т.е. уменьшение абсолютного значения дзета - потенциала.
Рассмотрим концентрационную коагуляцию на примере хлорида серебра, стабилизированного нитратом серебра. Формула мицеллы этого золя имеет вид:
{n[AgCl] m Ag+ (m - x) NO3-} xNO3-
График изменения потенциала в ДЭС этой мицеллы представлен на рис. 13.1. кривой 1.
 j А
j А
j0
x 2 1
h
В
Рис.13.1.Изменение падаения потенциала в ДЭС мицеллы хлорида серебра
1 - в исходной мицелле;
2 - после добавления такого количества KNO3, которое вызвало коагуляцию золя.
Потенциальная кривая взаимодействия частиц в этом золе предсталена на рис. 13.2. кривой 2.
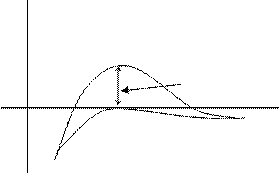 |
U
1 DUK
h
Рис.13.2.Потенциальная кривая взаимодействия частиц
1 - в исходном золе; 2 - после добавления KNO3.
Дзета - потенциал коллоидной частицы положительный, это создает потенциальный барьер коагуляции (DUк) > 0, кривая 1 на рис.15.2. Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит. При добавлении в золь KNO3, диффузный слой противоионов сжимается, формула мицеллы приобретает вид:
{n[AgCl] mAg+ mNO3-}
Изменение потенциала в ДЭС этой мицеллы представлено линией 2 на рис.13.1. Дзета - потенциал этой мицеллы равен нулю, следовательно DUк тоже равен нулю - кривая 2 на рис.13.2. Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения, при столкновении они слипаются - происходит коагуляция. Так как, по сути, эта коагуляция произошла в результате увеличения концентрации противоионов в золе ее называют концентрационной коагуляцией.
|
|
|
Нейтрализационная коагуляция - наблюдается в том случае, когда добавляется неиндифферентный электролит. Происходит нейтрализация потенциалопределяющих ионов путем связывания их в нерастворимое соединение, это приводит к уменьшению абсолютного значения термодинамического потенциала, а следовательно, и дзета - потенциала, вплоть до нуля.
Рассмотрим нейтрализационную коагуляцию также на примере хлорида серебра, стабилизированного нитратом серебра:
{n[AgCl] mAg+ (m - x) NO3-} xNO3-
Наша задача связать потенциалопределяющие ионы (Ag+) в нерастворимое соединение, в качестве которого выберем AgCl. Необходимые ионы Cl- нужно внести в исходный золь в виде любой хорошо растворимой соли, можно было бы использовать и хлороводородную кислоту (HСl), но тогда надо учитывать какое влияние окажет подкисление среды на величину дзета - потенциала, поэтому проще добавить хорошо растворимую соль, например, KСl. В этом случае мицелла имеет вид:
{[(n + m) AgCl]}
т.к. в системе нет ионов, способных адсорбироваться на поверхности частицы AgCl, присутствующие в системе ионы К+ и NO3- не способны достроить ее кристаллическую решетку. Таким образом, поверхность твердой частицы стала электронейтральной, ее термодинамический потенциал (j0) равен нулю, следовательно, дзета - потенциал также равен нулю. При столкновении такие частицы слипаются, происходит коагуляция.
Так как причиной коагуляции явилась нейтрализация потенциалопределяющих ионов мицеллы, приведшая к уничтожению заряда поверхности твердой частицы, то такую коагуляцию называют нейтрализационной коагуляцией. При осуществлении нейтрализационной коагуляции полезно вспомнить выражение:”все хорошо в меру”, т.к. неиндифферентного электролита надо добавлять строго эквивалентное количество, т.е. ровно столько, сколько нужно, чтобы связать все потенциалопределяющие ионы. Если же добавить избыток неиндифферентного электролита, то вместо коагуляции произойдет перезарядка поверхности твердой частицы:
|
|
|
{[(n + m) [AgCl] mCl- (m - x) K+} xK+
Правда, если добавить весьма большой избыток неиндифферентного электролита, то он будет действовать как любой сильный электролит и все - таки вызовет коагуляцию, но при этом мы потратим неоправданно большое количество электролита, тогда как нужного эффекта можно было бы добиться с меньшими затратами.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3667; Нарушение авторских прав?; Мы поможем в написании вашей работы!