
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекции. 1. Диффузионные процессы реагентов в системе – металлургические расплавы
|
|
|
|
1. Диффузионные процессы реагентов в системе – металлургические расплавы
2.Процессы адсорбции и десорбции на поверхности раздела фаз и химические реакции.
3.Применение теории диффузионной кинетики к окислительным пирометаллургическим процессам.
Цель оекции:
Ознакомление с кинетикой металлургических процессов
Дидактические единицы:
энергия активации; внутренняя энергия; адсорбция; абсорбция; мультиплет; активность
обезуглероживание.
1. Впервые метод рафинирования стали от вредных примесей специально приготовленным синтетическим шлаком был разработан в 1925 г. А. С. Точинским. В дальнейшем этот метод был опробован на многих заводах СССР и за рубежом, главным образом при рафинировании стали от фосфора известково-железистыми шлаками и от кислорода — кислыми шлаками. Вместе с тем как известково-железистые, так и кислые шлаки не получили распространения, ибо в первом случае удалялся не только фосфор, но и другие элементы _ (фосфор, кремний, углерод), а во втором обеспечивалось только раскисление стали.
В последнее время для рафинирования металла начали широко применять известково-глиноземистые шлаки, содержащие 53—54% СаО и 43—44% А12О3. Основой эффективного рафинирования стали жидким синтетическим шлаком является процесс эмульгирования шлака в металле, при котором резко возрастает поверхность соприкосновения между металлом и шлаком. При рафинировании металла в ковше размеры шлаковых частиц составляют 10—30 мк.
В работе Н. М. Чуйко рассмотрены некоторые теоретические вопросы обработки металла в ковше электропечными и синтетическими шлаками. Установлено, что эффект обработки металла шлаками зависит от следующих условий:
|
|
|
─ степени дробления и эмульгирования шлака на мелкие капельки и приближения системы металл — шлак к равновесию;
─ способности частичек шлаковой эмульсии укрупняться (коагуляция) и всплывать из металла;
─ раскислительной и десульфурирующей способности шлака, характеризуемой активной концентрацией закиси железа в нем, основностью и температурой.
Радиус частичек шлака при падении струи металла на него в первом приближении можно определить, пользуясь формулой
 (1)
(1)
где  — межфазное натяжение на границе металл — шлак; h — высота падения струи металла (от носка сливного желоба до уровня шлака в ковше); р — плотность металла; С — коэффициент обтекаемости (принимается обычно равным единице).
— межфазное натяжение на границе металл — шлак; h — высота падения струи металла (от носка сливного желоба до уровня шлака в ковше); р — плотность металла; С — коэффициент обтекаемости (принимается обычно равным единице).
Как видно из уравнения (1), радиус частичек шлаковой эмульcии увеличивается с повышением значений межфазного натяжения на границе металл — шлак и уменьшается с увеличением высоты падения струи металла. При малом межфазном натяжении шлак дробится лучше, но шлаковые включения хорошо смачиваются металлом, плохо отделяются от него и могут загрязнять сталь неметаллическими включениями.
На основе измерений установлено, что в системе СаО — А12О3 минимальную вязкость имеет шлак с содержанием 56% СаО. Крайне отрицательное влияние на вязкость известковоглиноземистого шлака оказывает Сr2О3. Если в шлаке содержится 3% Сr2Оз, то он при температурах обработки стали в ковше переходит в гетерогенное состояние, в результате чего вязкость шлака резко возрастает, поэтому содержание Сr2O3 в синтетическом шлаке не должно быть больше одного процента.
Как указывалось выше, в основе процесса рафинирования металла синтетическим шлаком лежат интенсивное перемешивание компонентов обеих реагирующих фаз и эмульгирование шлака в металле. Последнее подвержено влиянию большого числа факторов, что затрудняет изучение этого процесса в производственных условиях.
|
|
|
Для рафинирования качественных марок легированной стали на металлургических заводах применяются синтетические известково-глиноземистые шлаки, обладающие высокой рафинирующей способностью. Вместе с тем широкому внедрению указанных шлаков препятствуют необходимость установки шлакоплавильных агрегатов, трудности размещения их в действующих сталеплавильных цехах, дефицит глиноземсодержащих материалов и высокая стоимость шихтовых материалов.
При обработке жидкой стали в ковше шлаком способность последнего эмульгировать в металл и образовывать мелкие капли обусловливается его поверхностными свойствами на границе с газом и металлом. Силы сцепления внутри шлака определяются работой когезии. Силы сцепления между частицами шлака и металла характеризуются работой адгезии
 (2)
(2)
Установлено, что работа когезии шлака изменяется от 900 д о 1250 мДж/м2, адгезии шлака к металлу — от 700 до 1200 мДж/м2. При всех определениях работа адгезии шлака к металлу не превышала работу когезии шлака. Эти данные указывают на то, что эмульсия синтетического шлака и металла неустойчива, в результате чего запутывание в металле капелек шлака не происходит.
В технике широко применяются растворы, а не чистые вещества. Последние представляют собой лишь предельное состояние, которое в действительности не достигается. Получаемые методами вакуумной и зонной плавок чистейшие металлы содержат незначительные количества (10-6%) примесей, в основном металлоидов, и, по существу, являются растворами.
Растворы играют важную роль в металлургических процессах. Раствор является гомогенной смесью, образованной из нескольких веществ, находящихся в состоянии молекулярного раздробления. Согласно правилу фаз раствор представляет двух или многокомпонентную гомогенную часть системы, состав которой может меняться в пределах, определяемых взаимной растворимостью веществ. Таким образом, истинные растворы характеризуются гомогенностью и переменностью (в известных пределах) состава.
В сталеплавильных процессах получают развитие реакции окисления углерода, марганца, кремния, хрома, фосфора. Вместе с тем при определенных условиях в сталеплавильных процессах могут протекать реакции восстановления. Такие элементы, как марганец, хром, фосфор, окислившиеся в первые периоды плавки, в последующие периоды могут восстанавливаться из окислов или других соединеиий шлака и переходить в металл.
|
|
|
Окисление углерода является одной из главных физико-химических реакций сталеплавильных процессов. Несмотря на большое количество выполненных исследований, процесс окисления углерода в настоящее время изучен еще недостаточно, что объясняется крайней его сложностью и трудностыо проведения экспериментов.
Окисление углерода в стали протекает по двум реакциям:
1 → [С] + [О] ={СО}
2 → [С] + 2[О] ={СО2}
Реакция 2. протекает лишь при [%С] менее 0,05%, Рсо2 в смеси газов СО + СО2 составляет (при 1600°С) около 2 кПа.
Константа равновесия реакции 1 рассчитывается по уравнению
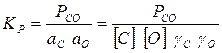 (3)
(3)
где а С и а О, [С] и [О], γС и γО — соответственно активности, концентрации, коэффициенты активности углерода и кислорода, растворенных в железе.
При давлении Рсо — 101,3 кПа и ус — уо = 1 (С ^ 1,0%) уравнение (3) упрощается и принимает вид
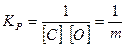 (4)
(4)
где m = [С][0].
Первые лабораторные исследования по определению численного значения т были выполнены Вачером и Гамильтоном. Расплавленное железо длительное время выдерживалось в смеси газов СО и СО2, после охлаждения определялось равновесное содержание углерода и кислорода, растворенных в железе. Установлено, что при температуре 1580—1620°С и РСО = 101,3 кПа произведение [С] • [О] составляет 0,0025—0,0026. В табл. 1 приведены формулы предложенные разными авторами для определения КР реакции (3), и найденные по ним значения КР и т при 1600°С [Н].
Таблица 1. Значения констант равновесия для реакции (1)
Температурная зависимость

| Значения при 1600О С | Авторы | |
| КС | m - = [C] [O] | ||

| 0.0025 | Cамарин Чипман | |
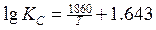
| 0.0023 | Рист Чипман | |

| 0.0025 | Явойский | |

| 0.0031 | Филипов | |

| 0.0021 | Ростовцев | |
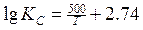
| 0.0033 | Крамаров Савамура | |
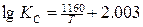
| 0.0025 | Матуба Сачио |
Экспериментальное изучение реакции 1 связано с большими трудностями, поэтому для нахождения термодинамических характеристик  и КР расчетным путем можно воспользоваться косвенным методом.
и КР расчетным путем можно воспользоваться косвенным методом.
|
|
|
Приняты следующие уравнения для расчета значений  реакций газификации графита и горения окиси углерода:
реакций газификации графита и горения окиси углерода:
С(гр) + СО2(г)↔2СО(г),  =160770 – 169,15 Т кДж (5)
=160770 – 169,15 Т кДж (5)
СО(г) + 1/2О2(г)↔СО2(г), 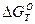 = - 278 970 + 84,67 Т кДж (6)
= - 278 970 + 84,67 Т кДж (6)
Температурная зависимость изменения стандартной свободной энергии процесса перехода кислорода из газообразного состояния (Рсо = 101,3 кПа) в жидкое железо выражается уравнением
1/2O2(г) = [О],  = - 71 220 – 28,51 Т кДж (7)
= - 71 220 – 28,51 Т кДж (7)
Для процесса растворения графита в жидком железе температурная зависимость изменения стандартной энергии определяется так:
С(гр)=с*[%С]  = 10 470 – 35,59 Т кДж (8)
= 10 470 – 35,59 Т кДж (8)
В результате комбинирования уравнений (3) и (4) получим следующее:
СО(г) + 1/2О2(г)↔СО2(г),  = - 118 200 + 84,48 Т кДж (9)
= - 118 200 + 84,48 Т кДж (9)
Из уравнений (7) и (5) находим путем комбинирования уравнение (10)
С(гр) + [О]↔СО(г), 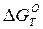 = - 460980 – 169,15 Т кДж (10)
= - 460980 – 169,15 Т кДж (10)
Комбинируя (6) и (8), получаем значения  для реакции (1):
для реакции (1):
[С] + [О]↔СО(г),  = - 57 450 – 20,38 Т кДж (11)
= - 57 450 – 20,38 Т кДж (11)
Отсюда находим температурную зависимость константы равновесия реакции 1:
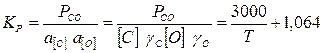 (12)
(12)
Для того чтобы протекал процеcс окисления углерода, фактическая концентрация кислорода в металле должна быть выше равновесной. На рис. 1 показана зависимость между содержанием [С] и [О] в металле для равновесных 2 и действительных условий сталеплавильных процессов.
Концентрация кислорода, растворенного в металле, в процессе плавки непрерывно изменяется. На основе результатов проведенных исследований было показано, что концентрация кислорода в сталеплавильной ванне определяется содержанием углерода и практически не зависит от основности и окисленности шлака, содержания марганца в металле, скорости окисления углерода.
Дальнейшие исследования показали, что при низких концентрациях углерода на окисленность ванны помимо содержания углерода оказывают влияние и другие параметры плавки.
С понижением концентрации углерода до 0,05—0,10% на содержание кислорода в металле начинают оказывать влияние окисленность шлака (FеО) и концентрация марганца в металле.
 Рис. 1. Зависимость между содержанием [С] и [О] в металле для равновесных 2 и деиствительных 1 условий сталеплавильных процессов.
Рис. 1. Зависимость между содержанием [С] и [О] в металле для равновесных 2 и деиствительных 1 условий сталеплавильных процессов.
2. При производстве легированных сталсй в металлическую ванну вводятся соответствующие легирующие-элементы. В табл. 2 представлены данные о стандартном изменении значений изобарных потенциалов образования окислов из злементов, растворенных в жидком железе. Из этих данных видно, что значения  реакции окисления Мо, Со, Мі, Си положительные. Последнее означает, что указанные элементы не могут окисляться в сталеплавильной ванне. Таким образом, все легирующие элементы разделяются на не окисляющиеся в условиях сталеплавильных процессов (Мо, Со, Ni, Си) и окисляющиеся (Zn, А1, Ті, Sі, V и др.).
реакции окисления Мо, Со, Мі, Си положительные. Последнее означает, что указанные элементы не могут окисляться в сталеплавильной ванне. Таким образом, все легирующие элементы разделяются на не окисляющиеся в условиях сталеплавильных процессов (Мо, Со, Ni, Си) и окисляющиеся (Zn, А1, Ті, Sі, V и др.).
Таблица 2. Стандартное изменение свободной энергии образовання окислов из элементов, растворенных в жидком железе

Из рассмотренных в табл. 2. элементов наибольшим сродством к кислороду обладает Zr, затем следуют АІ, ТІ, Sі, V, Сг, Мп. Окислы всех металлов (кроме железа) при І600°С находятся в твердом cocтоянии.
Реакция окисления марганца в кислородных конвертерах, мартеновских и электропечах легко достигает равновесия, после чего при определенных условиях начинается его восстановление из шлака в металл. Восстановление марганца является своего рода «пирометром» процесса, так как свидетельствует об интенсивном нагреве металлической ванны.
Окисление марганца в сталеплавильной ванне протекает по гетерогенной реакции
1 → 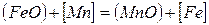
Константу равновесия реакции 1 запишем в следующем виде:
 (1)
(1)
Раствор марганца в железе можно считать идеальным, а состав стали близким к чистому железу. Тогда

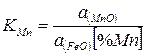 (2)
(2)
Согласно ионной теории процесс перехода марганца из металла в шлак описывается следующим образом:


Окисление марганца происходит на границе шлак— металл, так как фактическое содержание кислорода, растворенного в металлической ванне, ниже равновесного для реакции окисления марганца. В объеме гомогенной жидкой стали окисление марганца невозможно, так как в присутствии углерода содержание кислорода ниже равновесного по реакции марганца.
Хром входит в состав легированных сталей — конструкционных,нержавеющих, кислотоупорных, шарикоподшипниковых, магнитных и др. В условиях основного сталеплавильного процесса хром ведет себя так же, как и марганец: легко окисляется и переходит в шлак, а при определенных условиях (повышенные концентрации Сr2О3 в шлаке и температура) восстанавливается из шлака.
Наиболее устойчивым кислородным соединением хрома является Сr2О3. В шлаках кислого мартеновского процесса хром находится главным образом в виде СrО. В основных мартеновских печах окисление хрома происходит на границе раздела фаз шлак — металл пo следующей реакции:
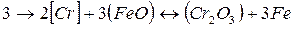
Kонстанта равновесия этой реакции

или

После соответствующих преобразований получим
 (3)
(3)
Из уравнения (3) следует, что содержание хрома в металле увеличивается с повышением концентрации хрома и уменьшением концентрации железа в шлаке.
Окись хрома Сr2О3 с другими окислами шлака образует сложные химические соединения. С закисью железа Сг2О3 дает хромит, имеющий температуру плавления 1990—2010°С (температура плавления Сг2Оз составляет 2275°С). Наличие в жидком шлаке твердых включений окислов хрома является главной причиной повышенной вязкости и низкой реакционной способности основных мартеновских шлаков. Шлак с повышенной концентрацией Сг2О3 обладает низкой теплопроводностью.
Поведение кремния в сталеплавильной ванне в зависимости от типа процесса различное. В основных сталеплавильных процессах происходит более полное окисление кремния, так как при наличии основного шлака активность кремнезема значительно понижается вследствие образования силикатов, в результате чего резко уменьшается возможность восстановления кремния из шлаковой фазы в металлическую. В кислых сталеплавильных процессах восстановителями Sі из SіО2 шлака или подины при определенных условиях могут быть Ғе, Мп и С.
Для реакции 4 → Sі02акр + 2[С] = [Sі] + 2СО величины  и 1gK [Sі] можно определить из следующих выражений
и 1gK [Sі] можно определить из следующих выражений
 =612.580 - 337.14 T кДж (4)
=612.580 - 337.14 T кДж (4)
 (5)
(5)
При Т=1823 K и [С]=.0,3% концентрация восстановленного кремния составляет 0,05%, при Т=1923К [51] =0,14%. Более высокие температуры процесса сопровождаются большими концентрациями восстановленного кремния.
Процесс восстановления кремния может быть описан уравнением
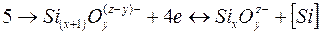
Электронейтральность металла и шлака обеспечивается в результате одновременно протекающих процессов:
Или
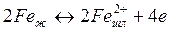
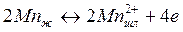
Химические реакции, протекающие в сталеплавильных процессах, характеризуются тремя основными укрупненными стадиями:
– подводом реагирующих веществ к зоне реакции, в которой происходит столкновение молекул, атомов, ионов;
– собственно химическим актом, в результате которого часть сталкивающихся частиц, обладающих запасом энергии, превышающим энергию активации, преобразуется в частицы продуктов реакции;
– отводом продуктов реакции из зоны взаимодействия.
В сталеплавильных процессах протекают главным образом химические реакции между компонентами, находящимися в разных фазах. На скорость таких реакций значительное влияние оказывают процессы подвода исходных веществ к поверхности раздела соприкасающихся фаз и отвода продуктов реакции от этой поверхности. Подвод реагирующих веществ к фронту гетерогенных реакций и отвод продуктов реакции из зоны взаимодействия существенно ускоряются при перемешивании фаз, в которых находятся реагирующие вещества, так как в этих условиях транспортировка веществ происходит в основном за счет турбулентной, а не молекулярной диффузии.
Повышенный интерес к изучению кинетики окисления углерода обусловлен ее определяющим влиянием на протекание основных металлургических процессов. Большой вклад в создание и развитие теории обезуглероживания внесли ученые Н. Н. Доброхотов, И. Г. Казанцев, М. Я. Меджибожский, С. И. Сапиро, Л. М. Ефимов, В. С. Кочо, Е. Я. Зарвин и др.
§3. Кинетические закономерности процесса окисления углерода изучены еще недостаточно, а выводы о лимитирующем звене не всегда однозначны. Расчеты значений кажущейся энергии активации позволяют определить лимитирующее звено сложных гетерогенных химических реакций. Считается, что лимитирующим звеном является химическая реакция и процесс находится в кинетической области, если энергия активации Е≈1050000 кДж/(кг-моль). При значениях Е≈210000 кДж/(кг-моль) процесс лимитируется диффузией и находится в диффузионной области. Промежуточные значения Е отвечают смешанной диффузионнокинетической области.
По данным различных исследователей кажущаяся энергия активации реакции окисления углерода колеблется от 63000 до 147000 кДж/(кг-моль). Такие значения Е свидетельствуют о протекании процесса окисления углерода в диффузионной области. Величина Е может быть рассчитана по формуле
 (1)
(1)
где К1 и К2 — константы скорости процесса при температурах Т и Т2.
Экспериментально установлено, что в период чистого кипения в мартеновекой ванне, когда кислород поступает в металл из атмосферы печи через шлак, при Т = 1800К скорость окисления углерода 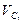 = 0,10% с/ч, а при Т = 1900 К
= 0,10% с/ч, а при Т = 1900 К  = 0,13% с/ч.
= 0,13% с/ч.
Если сохраняются равными прочие условия, можно принять, что V2/V1 = K2/K1. Тогда
 Полученное значение энергии активации реакции окисления углерода (71500 кДж) указывает на то, что процесс окисления углерода лимитируется одной из диффузионных стадий.
Полученное значение энергии активации реакции окисления углерода (71500 кДж) указывает на то, что процесс окисления углерода лимитируется одной из диффузионных стадий.
Реакция окисления углерода получает развитие тогда, когда общее давление в возникающих пузырьках окиси углерода (РСО) становится выше суммы атмосферного (Ратм), ферростатического (Рфер) и капиллярного (РКап) давлений:
 (2)
(2)
где hFе и hшл — высота слоя металла и шлака над образующимиея пузырькамя СО; ρFе и ρшл — плотность металла и шлака; σМГ — поверхностное натяжение металла на границе с газовым пузырьком. При радиусе пузырька окиси углерода критического размера r=10_9 μ и σМГ = 1000 мДж/м2 капиллярное давление составляет 2·106 кПа. Из-за ничтожно малой растворимости окиси углерода в металле, малого радиуса зародышей критического размера окиси углерода (порядка 10~9μ) и огромного капиллярного давления реакция окисления углерода в растворе невозможна.
Зарождение пузырьков окиси углерода на твердой поверхности значительно облегчается при плохой ее смачиваемости жидким металлом. Это уменьшает работу образования заррдышевых пузырьков окиси углерода критического размера. Однако решающее значение для зарождения пузырьков окиси углерода имеет шероховатость твердой поверхности. При ошлакованной подине зарождение пузырьков окиси углерода затрудняется.
При окислении углерода в металлической ванне мартеновских печей наблюдаются рудное и чистое кипение. Рудное (пенистое) кипение в сталеплавильной ванне является результатом зарождения огромного количества мельчайших пузырьков окиси углерода критического размера на границе шлак — металл. Увеличение их стабильности происходит под влиянием образования механически прочных адсорбционных пленок.
Чистое кипение в сталеплавильной ванне развивается в результате зарождения пузырьков СО критического размера на границе металл — подина, имеющих объем в 20—45 раз больший объема поверхиостных пузырьков СО. При подъеме объем пузырьков еще больше возрастает вследствие адсорбции газов из металла, объемного обезуглероживания на границе металл — пузырек, снижения ферростатического давления. Механическая прочность адсорбционных пленок резко понижается с увеличением объема пузырьков. На крупных пузырьках она ничтожно мала, поэтому они мгновенно разрушаются.
В начале рудного кипения при относительно низких температурах окисление углерода протекает преимущественно на границе металл — шлак.
Начиная с температуры 1560—1580°С, зарождение пузырьков окиси углерода происходит главным образом на подине, выгорание углерода идет также во всем объеме металла на поверхности выделяющихся на границе металл — подина пузырьков окиси углерода, при этом концентрация кислорода по глубине ванны выравнивается.
Интенсификация сталеплавильных процессов направлена на увеличение скорости обезуглероживания, что может быть достигнуто при условии увеличения поверхности, на которой протекает реакция обезуглероживания. Граница раздела шлак — металл и является такой поверхностью, которая одновременно служит поверхностью передачи кислорода из шлака в металл.
Исследования показали, что этапом, определяющим скорость обезуглероживания, является адсорбция кислорода металлом. Получены также уравнения, по которым может быть рассчитана скорость выгорания углерода с единицы поверхности расплава: при продувке смесью N2+О2
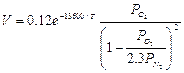 (3)
(3)
при продувке смесями (Не + О2) и (Аr+ О2)
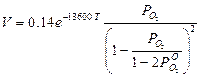 (4)
(4)
где 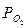 — фактическое давление в данный момент;
— фактическое давление в данный момент;  — исходное давление кислорода в газовой фазе.
— исходное давление кислорода в газовой фазе.
Окисление углерода в жидком металле в большинстве случаев протекает при наличии примесей, обладающих различной капиллярной активностью.
Интенсивность обезуглероживания металлической ванны и окисления марганца изучалась в работе экспериментально, где исходный металл содержал 3,5% С, 1% Мп, 1% 5І, 1% Сг. Все плавки начинались при температуре металла 1600°С. Первоначально опыты проводили по бинарной системе Fе - С, затем в расплав добавляли Мп, Sі, Сг. В результате взаимодействия кислорода с указанными элементами на поверхности металлического расплава протекали параллельные процессы окисления кремния, хрома и марганца. С их развитием происходило накопление шлака на границе раздела фаз металл — газ преимущественно у стенок тигля, что приводило к уменьшению площади окисления углерода, непосредственно контактирующей с газовой фазой. Скорость обезуглероживания выражается общим уравнением
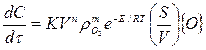 (5)
(5)
где 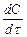 — скорость окисления углерода; К — константа скорости переноса кислорода к реакционной зоне;
— скорость окисления углерода; К — константа скорости переноса кислорода к реакционной зоне; 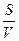 — соотношение поверхности и объема металлической ванны; {О}—концентрация окислителя в газовой фазе; п, т — постоянные величины для данных условий опыта.
— соотношение поверхности и объема металлической ванны; {О}—концентрация окислителя в газовой фазе; п, т — постоянные величины для данных условий опыта.
С увеличением размера выделяющихся пузырей окиси углерода увеличивалась поверхность реагирования и усиливался массоперенос в ванне. Этот процесс описывается уравнением

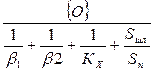 (6)
(6)
где Sп — суммарная реакционная поверхность; S шл — поверхность соприкосновения шлака с металлом; Vм — объем металлической ванны; {О} — концентрация активного киелорода в окислительной фазе; β1 — константа скорости переноса кислорода в окислительной фазе в направлении к металлу; β2 — константа скорости переноса кислорода внутри металла в направлении к реакционной зоне; KX — константа скорости химической реакции.
В процессе окисления углерода в сталеплавильной ванне образуется незначительное количество СО2. Анализ отобранных проб газа за период продувки металла в 350-тонных конвертерах показал, что в моменты максимальных скоростей обезуглероживания металла~ -~90% углерода окисляется в СО и 10% —в С02.
Интенсивное выделение продуктов реакции обезуглероживания может привести к выбросам металла и шлака. Возникновение выбросов при кислородно-конвертерном процессе вызывается общим повышением уровня конвертерной ванны в результате интенсивного образования газо-шлако-металлической эмульсии. При этом возникают значительные препятствия в отводе продуктов окисления углерода из реакционной зоны, сопровождающиеся, как иравило, взрывным характером выхода окиси углерода с выбросами шлака и металла из конвертера.
Перемешивание металлической и шлаковой фаз способствует ускорению сталеплавильных процессов.
В ходе обезуглероживания металлической ванны применительно к мартеновскому процессу можно выделить несколько стадий:
− переход кислорода из атмосферы печи в шлак,
− переход кислорода из шлака в металл,
− химическая реакция между кислородом и углеродом в металле,
− выделение окиси углерода в атмосферу печи.
Рассмотрим схему окисления углерода в ванне мартеновской печи для двух вариантов процесса:
− при постоянном количестве окислов железа в шлаке .(а)
− при малой окислительной способности атмосферы печи (б).
Для первого варианта процесса обезуглероживания характерны такие основные стадии:
- диффузия газа-окислителя к поверхности шлака;
- адсорбционно-химический процесс на границе шлак — газ
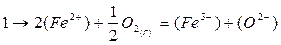
- диффузия ионов железа и кислорода в шлаке; разряд ионов О2~ на поверхности металл — шлак
(О2-) = [О] + 2е
- перезарядка трехвалентного железа в двухвалентное
(Fe2+) + 1e = (Fe2+)
- диффузия атомов кислорода и углерода к месту химической реакции между ними;
- реакция между углеродом и кислородом, растворенным в железе, [С] + [O]=СОГ;
- образование и удаление пузырьков СО.
Для второго варианта, когда окислительная способность атмосферы печи низкая, а шлак содержит значительное количество закиси железа, схема процесса несколько изменяется: воостановительным этапом становится стадия (Fе2+) + -+2е=[Fе] и появляется поток Fе2+ поверхности металл. Pис. 1.
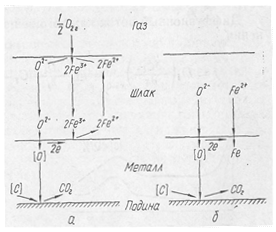
Рис. 1. Схема окисления углерода в ванне мартеновской печи:
а — при постоянном количестве окислов железа в шлаке; б — при малой окислительной способности мартеновской печи.
Экспериментальные исследования кинетики процессов окисления марганца и кремния немногочисленны. Вначале происходит быстрое окисление марганца до 0,1—0,2%, что обусловлено относительно низкой температурой, а следовательно, высокими значениями /Смп- В дальнейшем содержание марганца стабилизируется. В заключительной стадии процесса в связи с повышением температуры наблюдается восстановление марганца. Окисление и восстановление марганца происходят на границе шлак—металл. (Рис. 1)
В кислом процессе поведение кремния напоминает поведение марганца в основном процессе: быстрое окисление в начале, стабилизация в средине, восстановление в конце плавки, окисление в конце плавки при низком содержании углерода. При основном процессе кремний окисляется в начале плавки и в дальнейшем практически не восстанавливается из шлака (рис. 2).
Рассматривается распределение концентрации реагирующих веществ вблизи границы металл — шлак (рис. 3). Установлено, что концентрация исходных веществ вблизи реакционной поверхности меньше, чем в объеме металлической и шлаковой фаз, а продуктов реакции (Fе и Мen Оm) — больше. Изменение концентраций происходит в пределах диффузионного пограничного слоя δ толщина которого зависит от cкорости движения фаз, коэффициентов диффузии веществ и других факторов. Так как толщина диффузионного пограничного слоя зависит от величины коэффициента молекулярной диффузии, то она обычно составляет 6 — 10~5 — —10-4 м.
Диффузионный поток каждого вещества определяется из уравнения
 (7)
(7)
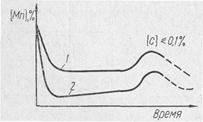
Рис. 1. Изменение концентрации марганца по
ходу процесса:
1 — основной процесс; 2 — кислый процесс
 Рис. 2. Изменение концентрации кремния по
Рис. 2. Изменение концентрации кремния по
ходу процесса:
1— кислый процесс; 2 — основной процесс.
где Кі и Di — константы скорости и коэффициент диффузии; С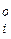 и Сі — концентрации в объеме фаз и вблизи границы металл — шлак. В этом уравнении знаки «минус» и «плюс» относятся соответствешю к исходнымвеществам и к продуктам реакции.
и Сі — концентрации в объеме фаз и вблизи границы металл — шлак. В этом уравнении знаки «минус» и «плюс» относятся соответствешю к исходнымвеществам и к продуктам реакции.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 696; Нарушение авторских прав?; Мы поможем в написании вашей работы!