
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые диаграммы и твёрдые растворы
|
|
|
|
Соединение деталей и узлов радиоэлектронной аппаратуры пайкой и сваркой
Фаза – это однородная часть материала системы (кристаллическая, аморфная, жидкая, газообразная или плазма).
Фазовая диаграмма – график, на котором в зависимости от давления, молярного объёма и температуры изображают фазовое состояние одного материала или системы из нескольких компонент. Бывают однофазные, двухфазные и трёхфазные состояния на этих диаграммах. Фазовая диаграмма необходима для объяснения свойств материала во всех случаях, когда речь идёт о взаимодействиях различных материалов. Это особо актуально для микроэлектроники, когда при изготовлении выводов и пассивировании слоёв используется большое многообразие материалов.

Для большинства случаев нет необходимости рисовать трёхфазные графики, на диаграмме возможно чётко различить области в которых материал существует только в одном состоянии. Двухфазные диаграммы возможно получить только на разделе фазовых состояний. Тройная точка возможна при определённом сочетании параметров, часто эта точка является характерной точкой отсчёта температур. Очень часто в качестве точки отсчёта выступает тройная точка воды (в прецизионных измерениях с использованием термопары, когда опорный спай контактирует с системой лёд-вода-пар).
На двойной диаграмме по оси ординат откладывается температура, а по оси абсцисс процентное соотношение компонентов смеси (в массовых или объёмных долях), давление обычно принимают равным одному атмосферному.
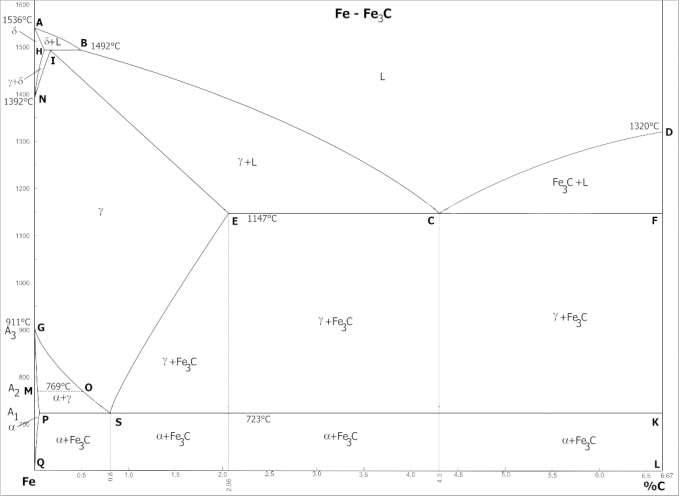
Рассмотрим двухкомпонентный состав состоящий из углерода (А) и железа (В) (здесь 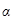 ,
, 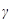 и
и 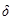 – состояния железа,
– состояния железа,  (
( ) – жидкая фаза, расплав). Линия ликвидус (например,
) – жидкая фаза, расплав). Линия ликвидус (например, 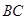 или
или 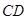 ) – это линия полного плавления твёрдых фаз. Линия солидус (например,
) – это линия полного плавления твёрдых фаз. Линия солидус (например,  ) – линия, когда исчезает последняя капля расплава.
) – линия, когда исчезает последняя капля расплава.
|
|
|
Точка пересечения двух линий ликвидус часто является точкой минимальной температуры при которой происходит плавление для всех комбинаций веществ А и В, эта точка называется точкой эвтектики (нонвариантная точка в системе из  компонент, в которой находится в равновесии
компонент, в которой находится в равновесии  твёрдых фаз и жидкая фаза).
твёрдых фаз и жидкая фаза).
Рассмотрим, как происходит переход из жидкой фазы в твёрдую. Допустим, что смесь имеет 4% содержание углерода и находится при температуре 1400 °С. При остывании с этой температуры до 1250 °С существует только жидкая фаза. Когда расплав остынет до 1250 °С начнётся кристаллизация и будет иметь место как жидкая фаза, так и твёрдая фаза  . При дальнейшем охлаждении процентное содержание жидкой фазы будет уменьшаться, а процент
. При дальнейшем охлаждении процентное содержание жидкой фазы будет уменьшаться, а процент  будет расти. При достижении температуры в 1147 °С (изотерма, в данном случае линия солидус) мы получим переходное состояние между
будет расти. При достижении температуры в 1147 °С (изотерма, в данном случае линия солидус) мы получим переходное состояние между  с жидкостью в
с жидкостью в  с
с 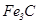 . При дальнейшем понижении температуры всё вещество перейдёт в твёрдое состояние. Если содержание углерода увеличивать до 4,3%, то при охлаждении до 1147 °С мы попадём в точку эвтектики в которой будут находиться в равновесии все 3 состояния
. При дальнейшем понижении температуры всё вещество перейдёт в твёрдое состояние. Если содержание углерода увеличивать до 4,3%, то при охлаждении до 1147 °С мы попадём в точку эвтектики в которой будут находиться в равновесии все 3 состояния  ,
, 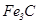 и расплав железа насыщенный углеродом. Таким образом можно определить состав фаз при любой температуре.
и расплав железа насыщенный углеродом. Таким образом можно определить состав фаз при любой температуре.
Количество вещества можно определить из условия сохранения суммарной массы. Например, если при какой-то температуре содержание одного из веществ равно 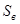 , то при условии сохранения суммы масс мы имеем:
, то при условии сохранения суммы масс мы имеем:  , здесь
, здесь  и
и 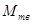 – масса вещества в жидком и твёрдом состоянии соответственно;
– масса вещества в жидком и твёрдом состоянии соответственно; 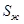 и
и 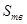 – содержание этого вещества в жидком и твёрдом состоянии. Из этого следует:
– содержание этого вещества в жидком и твёрдом состоянии. Из этого следует: 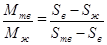 .
.
При температуре выше температуры эвтектики имеет место быстрое сплавление веществ  и
и 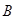 . Если при этом быстро охладить сплав, то атомы вещества
. Если при этом быстро охладить сплав, то атомы вещества  , будут пойманы в кристаллической решётке вещества
, будут пойманы в кристаллической решётке вещества 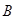 . Но если при нормальной температуре твёрдый раствор, например,
. Но если при нормальной температуре твёрдый раствор, например, 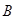 в
в  будет меньше, то в сплаве возникнет сильное напряжение, влияющее на его свойства (закалка). Но в микроэлектронике введение легирующих материалов до диффузии при повышенной температуре проводят с расчётом на исключение повреждений поверхности от избыточного сплавления (возможность появления второй фазы и связанной с ней деформацией).
будет меньше, то в сплаве возникнет сильное напряжение, влияющее на его свойства (закалка). Но в микроэлектронике введение легирующих материалов до диффузии при повышенной температуре проводят с расчётом на исключение повреждений поверхности от избыточного сплавления (возможность появления второй фазы и связанной с ней деформацией).
|
|
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 579; Нарушение авторских прав?; Мы поможем в написании вашей работы!