
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фотохимические реакции
|
|
|
|
Фотохимическими называются реакции, протекающие под действием света, а также невидимых лучей, близких по длине волны к видимому свету. В отличие от так называемых термических реакций, в которых энергия необходимая для преодоления энергетического барьера, обеспечивается за счет кинетической энергии наиболее быстро движущихся молекул, в случае фотохимических реакций дополнительная энергия приносится излучением.
Механизмы фотохимических реакций разнообразны. Несмотря на это, во всех случаях можно выделить первичные процессы, непосредственно вызываемые действием света, и вторичные реакции, не требующие освещения для своего протекания и называемые поэтому темновыми. К первичным процессам относятся следующие.
1.Возбуждение молекул или атомов, в результате чего образуются менее устойчивые частицы, способные к дальнейшим превращениям. Такая реакция записывается в виде уравнения
М + hn ® M*,
где hn - световой квант, а М* - возбужденная молекула.
2. Диссоциация молекул на атомы или радикалы (фотолиз):
АВ + hn ® A + B.
3. Ионизация молекул или атомов с выделением электрона (фотоэффект):
M + hn ® M+ + e.
Активные частицы, образовавшиеся в первичных процессах, могут вступать в химическое взаимодействие с обычными молекулами. Они, очевидно, могут и дезактивироваться, отдавая избыточную энергию путем излучения или превращения ее в теплоту. Активная частица может передавать свою энергию молекуле другого вещества, а та затем вступать в химическую реакцию.
В соответствии с законом, установленным Гротгусом (1817) и Дрепером (1839), химически активным является лишь то излучение, которое поглощается реакционной смесью. (I закон фотохимии).
|
|
|
Закон Вант-Гоффа - количество химически измененного вещества пропорционально количеству поглощенной световой энергии.
Пользуясь законом Ламберта- Бера, можно найти энергию света, поглощенного за единицу времени:
Q = I0 – I = I0(1 – e-enl),
где n - число поглощающих свет молекул в единице объема.
Наиболее важным для фотохимии является закон фотохимической эквивалентности Эйнштейна (1912). По этому закону каждый поглощенный квант света вызывает превращение одной молекулы (П закон фотохимии).
Данная эквивалентность справедлива лишь для первичных реакций. Количество молекул, участвующих в фотохимической реакции, может сильно отличаться от числа поглощенных фотонов. Величина g, равная отношению числа np прореагировавших молекул к числу nф поглощенных фотонов, называется квантовым выходом
g =  .
.
Пользуясь понятием квантового выхода, найдем скорость фотохимической реакции, выраженную количеством молекул, вступающих в реакцию за единицу времени:
v = 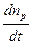 = g
= g =
= 
 ;
;
v = g (1 – e-enl).
(1 – e-enl).
Отсюда видно, что скорость фотохимической реакции пропорциональна интенсивности света, действующего на вещество, растет с ростом концентрации вещества и длиной l пути луча в растворе. Скорость реакции обратно пропорциональна частоте света. Последнее объясняется тем, что рост n увеличивает энергию hn каждого фотона и уменьшает их количество.
По закону фотохимической эквивалентности квантовый выход для первичных реакций должен быть равен единице. Для всей фотохимической реакции в целом он может сильно отличаться от единицы вследствие развития вторичных реакций. По этой причине величина g служит основой при классификации фотохимических реакций.
Реакции с квантовым выходом g = 1. К числу таких сравнительно малочисленных реакций относятся образование перекиси водорода из газообразной смеси водорода с кислородом, разложение сероводорода в бензольном растворе.
|
|
|
Реакции с квантовым выходом g < 1. Обычно g < 1 для реакций в газах, находящихся под малым давлением.
Реакции с квантовым выходом g > 1. Примером является реакция фотолиза йодистого водорода:
2НI + hn ® H2 + I2.
Реакции с g >>1. Очень большим квантовым выходом характеризуются фотохимические цепные реакции.
Фотохимические реакции отличаются слабой зависимостью скорости от температуры. Это объясняется тем, что за счет поглощения света в первичных реакциях приобретается настолько большая энергия, что повышение температуры может изменить ее лишь незначительно.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1562; Нарушение авторских прав?; Мы поможем в написании вашей работы!