
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомогенный катализ
|
|
|
|
Главным положением теории гомогенного катализа является представление о том, что в ходе реакции образуются неустойчивые промежуточные соединения катализатора с peaгирующими веществами, которые затем распадаются с регенерацией катализатора.
В общем случае для реакции типа: А + В = Р образуется промежуточное соединение одного из реагентов с катализатором А + К = АК, затем это соединение взаимодействует с другим исходным веществом и дает продукты реакции и катализатор
АК+В ® Р+К.
При теоретическом рассмотрении кинетики гомогенных каталитических реакций часто предполагается, что промежуточные соединения находятся в равновесии с исходными веществами. Такие промежуточные соединения называют веществами Аррениуса. В этом случае схема реакции типа
А + В = Р запишется следующим образом:
А + К «АК;
АК + В ® Р + К.
Так как считается, что промежуточное соединение находится в равновесии с исходными веществами, то v1 = v2. Отсюда, обозначая через ск суммарную концентрацию катализатора, получим
k1cA(cK – cAK) = k2cAK.
Найдем из этого уравнения концентрацию промежуточного соединения
cAK = 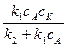 ;
;
и подставим в выражение скорости реакции (ввиду того, что продукты последней стадии одновременно являются продуктами суммарной реакции, скорость данной реакции равна скорости последней стадии):
v = k3cAKcB = 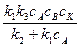 .
.
Уравнение указывает на существование двух предельных случаев:
1) если k1cA << k2, то v =  cAcBcK; 2) если k2 << k1cA то v = k3cBcK..
cAcBcK; 2) если k2 << k1cA то v = k3cBcK..
В обоих случаях скорость реакции прямо пропорциональна концентрации катализатора, как это обычно и бывает на практике. Суммарный порядок реакции по исходным веществам различен и принимает значение, равное единице или двум. Вне указанных предельных случаев порядок реакции дробный (1 < n < 2).
Промежуточные вещества, которые нельзя считать находящимися в равновесии с исходными веществами, называются веществами Вант-Гоффа. При рассмотрении кинетики реакций с промежуточными веществами Вант-Гоффа часто используется метод стационарных концентраций, т. е. предполагается, что концентрация промежуточного вещества с течением времени остается постоянной.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!