
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная теория
ТЕОРИЯ АКТИВНЫХ АНСАМБЛЕЙ
Согласно этой теории, предложенной Н. И. Кобозевым в 1939 г., каталитически активным центром является совокупность (ансамбль) свободных атомов катализатора, находящихся на отдельном участке блока поверхности твердого тела. Эти атомы не входят в кристаллическую решетку и могут свободно мигрировать в пределах каждого блока. Разделение поверхности на отдельные блоки происходит вследствие образования микроскопических трещин, наличия примесей и различного рода неоднородностей поверхности реальных тел. Предполагается, что остальные атомы катализатора образуют кристаллическую фазу и играют роль неактивной подложки.
Опыты показали, что каталитическая активность адсорбционных катализаторов с увеличением количества атомов катализатора, находящихся на поверхности носителя, обычно возрастает лишь до некоторого предела, а затем снова уменьшается. Образование максимума на кривой активности с ростом степени заполнения поверхности атомами катализатора (отношение площади занятой поверхности ко всей поверхности катализатора) объясняется изменением числа ансамблей, состоящих для каждой реакции из строго определенного количества атомов.
Теория активных ансамблей позволяет использовать опытные данные для расчета количественного состава и активности каталитически активных центров. Было установлено, что для окислительных процессов активен одноатомный ансамбль, для реакций гидрирования - двухатомный и т. п. Изменение структуры поверхности и размера блоков, происходящее при введении примесей или вследствие термообработки и рекристаллизации, влияет на количество атомов в ансамблях. Этим объясняется промотирование, действие ядов и влияние способа приготовления катализатора на его активность.
Электронные представления в катализе начали развиваться в 30-х годах XX в. Писаржевским, Волькенштейном, Хауффе и др. Электронная теория катализа основывается на квантовомеханической зонной теории твердого тела.
Рассмотрим ионный кристалл полупроводника MR, состоящий из однозарядных катионов М+ и анионов.R-. Электропроводность такого кристалла связана с тем, что часть электронов, обладающая повышенной энергией, делокализуется и может свободно перемещаться по кристаллу. В свете элементарных химических представлений это значит, что электрон переходит от аниона к катиону с образованием в двух соседних узлах кристаллической решетки двух нейтральных атомов:

У ионов М+ и R- (например, Na+ и С1-) имеются замкнутые восьмиэлектронные оболочки и отсутствуют свободные неспаренные (валентные) электроны. У электроположительного атома имеется валентный электрон—свободная положительная валентность (n-связь). У электроотрицательного атома отсутствует один электрон в восьмиэлектронной оболочке, что равнозначно появлению эффективного положительного заряда (дырке) или отрицательной свободной валентности (р-связь). Для катализа имеет значение появление таких свободных валентностей на поверхности твердого тела:

Горизонтальные отрезки на схеме изображают поверхность катализатора. Электрон может перемещаться по катионной подрешетке (электронная проводимость); дырка—по анионной подрешетке (дырочная проводимость).
В настоящее время эти элементарные представления получили уточнение в зонной теории твердого тела. В твердом теле электронные энергетические уровни атома расщепляются в энергетические полосы. При этом в полупроводниках между энергетической полосой валентных электронов атомов твердого тела (валентная зона) и энергетической полосой возбужденных электронов (зона проводимости) имеется некоторый промежуток (запрещенная зона), в котором (в случае идеального кристалла без примесей) нет энергетических уровней электронов. Чтобы перейти из валентной зоны в зону проводимости, электрону нужно иметь некоторую минимальную избыточную энергию активации, равную ширине запрещенной полосы. Переход электрона из валентной зоны в зону проводимости соответствует перескоку электрона с аниона на катион и его перемещению по катионной подрешетке (электронная, или n-проводимость). После перехода электрона в зону проводимости в валентной зоне остается дырка, которая соответствует аниону, лишенному электрона, и перемещению этой дырки по анионной подрешетке (дырочная, или р-проводимость).
Электронная теория катализа допускает существование разных видов связи хемосорбированных частиц из газа на поверхности полупроводника: слабой одноэлектронной связи и двух видов прочной двухэлектронной связи — акцепторной и донорной, которые в свою очередь могут иметь ковалентный или ионный характер в зависимости от природы адсорбируемой частицы. Предположим, что адсорбируемая частица является одновалентным атомом: электроположительным атомом А (типа Na) или электроотрицательным атомом В (типа С1), а катализатор — полупроводниковый ионный кристалл состава MR (типа NaCl), который имеет в узлах решетки и на поверхности кристалла частицы: М+, R-, М и R. При этом будут наблюдаться следующие шесть случаев химической связи, показанные на схеме (в двух случаях — 2 и 5 — связь не образуется).

Как видно из схемы, при адсорбции атома (или радикала) на свободной валентности образуется прочная связь (случаи 3, 4 и 7, 8). При этом свободная валентность расходуется на образование химической связи, которая в предельных случаях может быть ионной или ковалентной. Такой адсорбированный атом или радикал не реакционноспособный. У адсорбированного атома или радикала в состоянии слабой связи остается свободная валентность (случай 1 и 6); он является реакционноспособным и вступает в химические реакции.
Свободные валентности (электроны и дырки) могут перемещаться (блуждать) по кристаллу. Поэтому прочная связь может переходить в слабую, а слабая в прочную. В зависимости от характера полупроводника (n- или р - полупроводник) на нем будет протекать адсорбция преимущественно на прочной акцепторной или прочной донорной связи и соответственно будет меняться избирательность (селективность) полупроводникового катализатора. Если адсорбируются молекулы, то при адсорбции их в форме прочной связи в них обычно рвутся связи между атомами, молекула превращается в радикал и это способствует осуществлению катализа. Например, при адсорбции двухатомной молекулы АВ с одинарной связью на прочной связи происходит диссоциация молекулы на адсорбированные атомы А и В. При адсорбции молекулы с двойной связью рвется одна связь и образуется радикал. Эти процессы можно представить на схеме
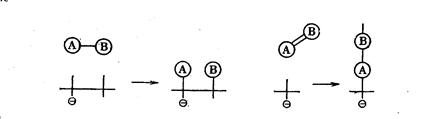
В электронной теории катализа преимущественно рассматриваются реакции, протекающие с промежуточным образованием атомов и радикалов (радикальные механизмы реакций). Приведем две схемы простых радикальных каталитических реакций согласно электронной теории катализа.
1. Гидрирование этилена на дырочном полупроводнике (р-типа) можно изобразить схемой
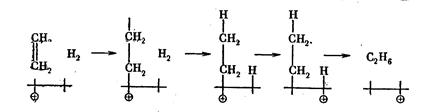
Роль активных центров играют при этом дырки в валентной зоне. Опыт подтверждает, что факторы, способствующие увеличению р - связей в полупроводнике, благоприятствуют катализу этой реакции на полупроводниках.
2. Окисление водорода на полупроводниках n-типа можно представить следующей возможной схемой:

Роль активных центров играют при этом электроны в зоне проводимости. В соответствии с опытом реакция ускоряется при наличии в полупроводнике электронно-донорных примесей.
Основной недостаток электронной теории катализа на полупроводниках заключается в том, что свойства поверхности полупроводника сопоставляются с физическими свойствами твердого тела, хотя между ними имеется только косвенная связь. И те и другие зависят от химического состава и структуры вещества катализатора, но зависимость эта может быть разная.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1.Краткий курс физической химии. Под ред. С. Н. Кондратьева. – М.: Высш. школа, 1978.- 312 с.
2. Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высш. школа, 1973.- 480 с.
3.Физическая химия. Под ред. К.С. Краснова. – М.: Высш. школа, 1982.- 687 с.
4. Герасимов Я.И. и др. Курс физической химии. Т.1. – М.: Химия, 1969.- 592 с.
5.Краткий справочник физико-химических величин. Под ред. К.П.Мищенко. – Л.: Химия, 1983.- 232 с.
6. Кудряшов И.В., Каретников Г.С. Сборник примеров и задач по физической химии. – М.: Высш. школа, 1991.- 527 с.
СОДЕРЖАНИЕ
с
Электрохимия
Введение 3
Исторический очерк 3
Растворы электролитов
Основы теории электролитической диссоциации 5
Причины электролитической диссоциации 6
Теория сильных электролитов Дебая и Гюккеля 6
Электропроводность растворов электролитов
Удельная и эквивалентная электропроводности 7
Закон Кольрауша 8
Зависимость электропроводности слабых и сильных электролитов от концентрации электролита 10
Подвижность и числа переноса ионов 13
Кондуктометрия 14
Электродвижущие силы и равновесные электродные потенциалы
Гальванический элемент и электролизер. Законы электролиза 17
Термодинамика гальванического элемента 19
Скачки потенциала на границах фаз в электрохимических системах 20
Электродные потенциалы 21
Классификация электродов 23
Водородный электрод 24
Каломельный электрод 25
Измерение ЭДС. Нормальный элемент 25
Концентрационные цепи 27
Диффузионные потенциалы 27
Окислительно-восстановительные электроды и цепи 28
Применение потенциометрических методов 29
Стеклянный электрод 30
Потенциометрическое титрование 31
Неравновесные электрохимические процессы
Поляризация 32
Концентрационная поляризация 35
Электрохимическое перенапряжение 36
Перенапряжение выделения водорода 37
Полярография 39
Химические источники тока 40
Электрохимическая коррозия металлов 44
Методы защиты металлов от коррозии 46
Химическая кинетика
Скорость химической реакции 49
Кинетическая классификация реакций 50
Необратимая реакция первого порядка 51
Необратимая реакция второго порядка 53
Обратимая реакция первого порядка 54
Обратимая реакция второго порядка 56
Параллельные реакции 57
Последовательные реакции 58
Методы определения порядка реакций 60
Влияние температуры на скорость реакции 62
Теория активных столкновений молекул 65
Применение теории столкновений к бимолекулярным реакциям 66
Бимолекулярный механизм мономолекулярной реакции 68
Теория активного комплекса или переходного состояния 70
Цепные реакции 75
Фотохимические реакции 78
Особенности гетерогенных процессов 80
Каталитические реакции
Особенности и классификация каталитических процессов 81
Гомогенный катализ 82
Обобщенная теория кислот и оснований. Кислотно-основный катализ 83
Гетерогенный катализ 85
Стадии гетерогенных каталитических процессов 86
Теории гетерогенного катализа
Мультиплетная теория 88
Теория активных ансамблей 89
Электронная теория 89
Список использованной литературы 93
Учебное издание
Быковский Владимир Сергеевич
ФИЗИЧЕСКАЯ ХИМИЯ
Редактор Л.А. Матвеева
Подписано в печать 20.08.03. Бумага офсетная № 2. Формат 60х84 1/16
Гарнитура «Таймс».Печать офсетная. Усл.-печ.л. 5,9. Уч.-изд.л. 5,3.
Тираж 100 экз. Заказ.
Издательство Уфимского государственного нефтяного технического
Университета
Адрес издательства:
450062, г. Уфа, ул. Космонавтов, 1.
Отпечатано методом ризографии.
Адрес типографии:
453118, г. Стерлитамак, пр. Октября, 2.
|
|
Дата добавления: 2014-01-05; Просмотров: 3630; Нарушение авторских прав?; Мы поможем в написании вашей работы!