
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Явление осмоса. Закон Вант-Гоффа
|
|
|
|
Гидролиз
Гидролиз – обменная реакция между растворяемым веществом и водой.
Гидролизу подвергаются только растворимые соли.
Соли, образованные сильным основанием и сильной кислотой не гидролизуются, их растворы нейтральны (рН=7).
Гидролиз идет до конца, если в результате реакции образуется мало-диссоциирующее вещество, выпадает осадок или выделяется газ.
Пример необратимого гидролиза:
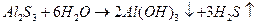
При соприкосновении двух растворов различной концентрации, разделенных полупроницаемой мембраной происходит самопроизвольный перенос вещества из одной фазы в другую. Это явление называется осмосом.
Осмос обусловлен стремлением молекул растворителя выровнять свою концентрацию по обе стороны мембраны.
Осмос количественно характеризуется осмотическим давлением.
Осмотическое давление равно тому внешнему гидростатическому давлению, которое необходимо приложить к системе, чтобы осмос прекратился.
Изучая осмотическое давление различных растворов Вант-Гофф (1852-1911г.) пришел к выводу, что растворенное вещество ведет себя в растворе подобно газообразному веществу, оно стремится занять весь объем растворителя, так же как газ, заключенный в определенную емкость.
Вант-Гофф предложил для вычисления осмотического давления пользоваться уравнением идеального газа:

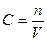
С – концентрация растворенного вещества, моль/л;
n – число молей растворенного вещества;
V – удельный объем, л;
Р – давление газа;
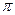 -осмотическое давление, атм.
-осмотическое давление, атм.
R = 8,314 Дж/моль К
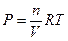
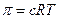
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1234; Нарушение авторских прав?; Мы поможем в написании вашей работы!