
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные индикаторы
Кислотно-основными индикаторами или просто индикаторами, называют
вещества, меняющие свою окраску в определенной области значений рН
раствора.
Индикаторами могут быть слабые органические кислоты HInd и основания IndOH, молекулы и ионы которых имеют разную окраску.
В кислых растворах индикаторы, представляющие собой слабые кислоты, в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул и окраска раствора соответствует молекулярной форме индикатора HInd. Если индикатор кислота, то диссоциация его идет по схеме:

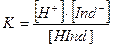
Изменение концентрации Н+ или ОН- сильно влияет на степень диссоциации Ind.
Если Ind – кислота, то с увеличением Н+ степень диссоциации 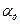 снижается; с увеличением ОН-
снижается; с увеличением ОН- 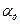 повышается.
повышается.
Индикаторы, являющиеся слабыми основаниями, в растворах кислот, напротив, будут находиться в ионной форме Ind+, которая определяет окраску раствора
Если индикатор – основание, то диссоциация его идет по схеме:

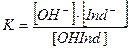
С увеличением Н+ степень диссоциации 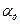 повышается; с увеличением ОН-
повышается; с увеличением ОН- 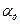 снижается.
снижается.
Кислой формой индикатора называют форму, которая преобладает в кислых растворах, основной – в щелочных.
В некотором промежутке значений рН в растворе могут одновременно находится обе формы индикатора, вследствие чего возникает переходная окраска индикатора.
Область значений рН, в которой совершается переход одной формы индикатора в другую, называется интервалом перехода индикатора.
Таблица
| Индикатор | Интервал перехода | Изменение окраски | |
| Метиловый-фиолетовый | 1,2-2,8 | Желтая | Фиолетовая |
| Метиловый-оранжевый | 3-4,4 | Красная | Желто-оранжевая |
| Метиловый-красный | 4,3-6,2 | Красная | Желтая |
| Лакмус | 5-8 | Красная | Синяя |
| Фенолфталеин | 8,1-9,8 | Бесцветная | Малиновая |
| Ализариновый желтый | 10-12 | Бледно-желтый | Желто-Коричневый |
| Индиго карминовый | 11,6-14 | Синяя | Желтая |
Имея набор индикаторов можно с точностью  0,3 рН определить активную кислотность раствора.
0,3 рН определить активную кислотность раствора.
Метод определения рН растворов с помощью индикаторов состоит в том, что последовательно фиксируют изменение окраски нескольких индикаторов в отдельных пробах раствора, рН которого требуется установить. Точность метода составляет  0,3 ед. рН.
0,3 ед. рН.
Установление значения рН, при котором наступает нейтрализация кислоты или основания используется для определения их концентраций.
Имеются специальные приборы - рН-метры, с помощью которых можно
определить рН растворов в диапазоне от 0 до 14 с точностью до 0,01
единицы рН, метод анализа воды называется рН-метрией.
рН–метрия – совокупность потенциометрических методов определения водородного показателя рН. Они основаны на измерении эдс гальванического элемента, состоящего из индикаторного электрода и электрода сравнения. Возникающая величина эдс пропорциональна концентрации ионов водорода в исследуемом растворе.
Метод рН-метрии может быть использован для определения концентрации кислот, оснований без использования индикатора, а также концентрации ионов тяжелых металлов с использованием в качестве индикаторного (измерительного) электрода, соответствующего ион-селективного электрода.

 рН
рН
 |
С
Важную роль во многих биологических и технологических процессах играет водородный показатель среды. Значение рН можно поддерживать на практически постоянном уровне путем применения буферных смесей.
|
|
Дата добавления: 2014-01-05; Просмотров: 733; Нарушение авторских прав?; Мы поможем в написании вашей работы!