
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства оксидов
Оксиды
Оксиды — соединения, образованные атомами двух элементов, одним из которых является кислород в степени окисления (– 2).
К оксидам относятся все соединения элементов с кислородом, например Fe2O3, P4O10, кроме содержащих атомы кислорода, связанные химической связью друг с другом (пероксиды, надпероксиды, озониды), например,
Na2O2 — пероксид натрия: 
KO2 — надпероксид калия: K+[O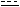 O] –
O] –
KO3 — озонид калия: K+[O O
O O] –
O] –
и соединения фтора с кислородом (OF2, O2F2), которые следует называть не оксидами фтора, а фторидами кислорода, т. к. степень окисления кислорода в них положительная:
 ;
; 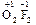 .
.
Температуры плавления и кипения оксидов меняются в очень широком интервале. При комнатной температуре они, в зависимости от типа кристаллической решетки, могут находиться в различных агрегатных состояниях. Это определяется природой химической связи в оксидах, которая может быть ионной или ковалентной полярной.
В газообразном и жидком состояниях при комнатной температуре находятся оксиды, образующие молекулярные кристаллические решетки. С увеличением полярности молекул температуры плавления и кипения повышаются, см. табл. 1.
Таблица 1
Температуры плавления и кипения некоторых оксидов
(давление 101,3 кПа)
| CO2 | CO | SO2 | ClO2 | SO3 | Cl2O7 | H2O | |
| Т пл., °C | – 78 (Т возгоки) | – 205 | – 75,46 | – 59 | 16,8 | – 93,4 | |
| Т кип., °C | – 191,5 | – 10,1 | 9,7 | 44,8 |
Оксиды, образующие ионные кристаллические решетки, например, CaO, BaO и др. являются твердыми веществами, имеющими очень высокие температуры плавления (> 1 000°C).
В некоторых оксидах связи ковалентные полярные. Они образуют кристаллические решетки, где атомы элемента связаны несколькими “мостиковыми” атомами кислорода, образуя бесконечную трехмерную сеть, например, Al2O3, SiO2, TiO2, BeO и эти оксиды тоже имеют очень высокие температуры плавления.
|
|
Дата добавления: 2014-01-05; Просмотров: 1200; Нарушение авторских прав?; Мы поможем в написании вашей работы!