
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения оснований
|
|
|
|
Классификация оснований
Основания
В этом разделе будут рассмотрены только неорганические основания с позиции электролитической теории.
Основания могут быть классифицированы по следующим свойствам.
1°. Кислотность основания — число групп OH- способных обмениваться на кислотный остаток. Например, NaOH — однокислотное основание, Ca(OH)2 — двухкислотное основание. По этому признаку основания бывают одно-, двух- и т. д. кислотными. Многокислотные основания диссоциируют ступенчато и могут образовывать несколько рядов солей, например, (MgOH)2CO3 — гидроксокарбонат (основной карбонат) магния; MgCO3 — карбонат (средний карбонат) магния.
2°. Растворимость. Гидроксиды щелочных металлов, металлов главной подгруппы второй группы, начиная с кальция, гидроксид таллия (I) [TlOH] и гидроксид аммония растворимы в воде. Гидроксиды других металлов в воде практически нерастворимы.
3°. Сила оснований, также как и других электролитов, определяется степенью диссоциации (или констанотой диссоциации). Сильными основаниями являются гидроксиды щелочных и щелочноземельных металлов. Сильные, растворимые в воде основания называются щелочами.
4°. Термическая устойчивость оснований. При нагревании большинство оснований разлагаются на оксид металла и воду. Устойчивыми являются гидроксиды щелочных металлов, начиная с натрия, они плавятся без разложения. Гидроксиды лития, стронция, бария и радия разлагаются при температуре несколько выше температуры плавления, гидроксиды остальных металлов разлагаются до плавления.
5°. По отношению к кислотам и щелочам гидроксиды металлов можно разделить на основные и амфотерные. К основным гидроксидам относятся гидроксиды, растворяющиеся только в кислотах и не реагирующие со щелочами, к амфотерным — гидроксиды, растворяющиеся как в кислотах, так и в щелочах.
|
|
|
Основными являются гидроксиды щелочных и щелочноземельных металлов, а также гидроксид магния и гидроксиды переходных металлов в низших степенях окисления, например, Cr(OH)2, Mn(OH)2 и др.
Амфотерными являются гидроксиды Be(OH)2, Zn(OH)2, Al(OH)3, Sn(OH)2, гидроксиды переходных металлов в промежуточных степенях окисления, например, Cr(OH)3, Fe(OH)3.
Основания могут быть получены одним из следующих способов.
1°. Взаимодействием щелочных и щелочноземельных металлов с водой:
2 Li + 2 H2O = 2 LiOH + H2
Sr + 2 H2O = Sr(OH)2 + H2.
Этим же способом может быть получен гидроксид аммония:
NH3 + H2O = NH3 × H2O «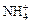 + OH –.
+ OH –.
В отличие от предыдущих примеров эта реакция протекает без изменения степеней окисления.
Другие металлы, стоящие в ряду электродных потенциалов до водорода, также могут реагировать с водой, но эти реакции протекают при высоких температурах и обратимы. При этом образуются не гидроксиды металлов, а оксиды, т. к. гидроксиды при этих температурах термически неустойчивы, например,
Fe + H2O «FeO + H2 (при t > 570°C).
2°. Растворением оксидов и пероксидов щелочных и щелочноземельных металлов в воде:
CaO + H2O = Ca(OH)2¯
Na2O2 + 2 H2O = 2 NaOH + H2O2.
Оксиды других металлов с водой не взаимодействуют.
3°. Гидролизом солей, у которых он протекает до конца:
Al2S3 + 6 H2O = 2 Al(OH)3¯ + 3 H2S .
4°. Смешиванием водных растворов солей, взаимно усиливающих гидролиз:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3¯ + 6 NaCl + 3 CO2.
5°. Разложением некоторых бинарных соединений металл-неметалл (гидридов, нитридов, фосфидов и др.) водой, например:
Li3N + 3 H2O = 3 LiOH + NH3
NaH + H2O = NaOH + H2
Ca3P2 + 6 H2O = 3 Ca(OH)2 + 2 PH3
Mg2Si + 4 H2O = 2 Mg(OH)2¯ + SiH4.
6°. Электролизом водных растворов хлоридов щелочных и щелочноземельных металлов:
2 NaCl + 2 H2O 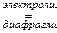 2 NaOH + Cl2 + H2.
2 NaOH + Cl2 + H2.
Для получения гидроксидов этим способом необходимо разделить катодное и анодное пространства, иначе будет происходить взаимодействие хлора со щелочью с образованием других продуктов.
|
|
|
7°. Важнейшим способом получения слабых, нерастворимых в воде оснований является осаждение их из растворов солей щелочами или раствором аммиака
MgSO4 + 2 KOH = Mg(OH)2¯ + K2SO4
AlCl3 + 3 NH4OH = Al(OH)3¯ + 3 NH4Cl.
При осаждении амфотерных гидроксидов щелочами полноту осаждения можно достичь только при смешении строго эквимолярных количеств соли и щелочи. Поэтому для осаждения амфотерных гидроксидов используют раствор аммиака в воде. Аммиаком нельзя осаждать гидроксиды тех металлов, которые образуют с ним комплексные катионы.
Гидроксид аммония не может быть получен таким способом, т. к. повышение концентрации анионов OH – приводит к уменьшению растворимости аммиака в воде и выделению его из раствора в виде газа:
NH4Cl + NaOH = NH3 + H2O + NaCl.
Этот же способ применим и для получения растворимых в воде оснований:
Ca(OH)2 + Na2CO3 «2 NaOH + CaCO3¯ (каустизация соды).
Сдвиг равновесия в сторону образования NaOH достигается за счет образования CaCO3, обладающего меньшей растворимостью, чем Ca(OH)2.
Для большего смещения равновесия в сторону образования гидроксида щелочного металла используют гидроксид бария и сульфат соответствующего щелочного металла:
Ba(OH)2 + Cs2SO4 = BaSO4¯ + 2 CsOH.
8°. Окислением катиона, находящегося в низшей степени окисления, до высшей:
4 Fe(OH)2 ¯ + O2 + 2 H2O = 4 Fe(OH)3 ¯.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3820; Нарушение авторских прав?; Мы поможем в написании вашей работы!