
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции (ОВР)
|
|
|
|
Ионные уравнения реакций.
Согласно теории электролитической диссоциации все реакции в водных растворах являются реакциями между ионами.
Реакции, протекающие между ионами, называются ионными реакциями. А уравнения этих р-ций – ионными уравнениями.
При составлении ионных ур-ний р-ций надо помнить, что в виде ионов записываются сильные электролиты, а малодиссоциированные, малорастворимые (осадок) и газообразные в виде молекул.
FeCl3 + 3NaOH → Fe (OH)3 ↓ + 3NaCl
Fe 3+ + 3Cl ‾ + 3Na+ + 3OH ‾ →? Fe (OH)3 ↓ + 3Na+ + 3Cl ‾
полное ионное уравнение реакции
Удалим (исключим) одинаковые ионы, т.е.ионы, не участвующие в р-ции.
Fe 3+ + 3OH ‾ → Fe (OH)3 ↓
сокращенное ионное уравнение реакции
Если при р-циях между ионами не происходит изменения зарядов ионов (не изменяется степень окисления), то они наз-ся реакциями ионного обмена.
Реакции обмена идут до конца, если в р-те р-ции образуется осадок, газ, слабый электролит или комплексное соединение.
1) NaCl + AgNO3 = AgCl ↓ + NaNO3
Na + + Cl ‾ + Ag + + NO3 ‾ → AgCl ↓ + Na + + NO3 ‾
Cl ‾ + Ag + → AgCl ↓
2) Na 2CO3 + H2SO4 →? Na2SO4 + CO2 ↑ + H2O
2Na + + CO3 2 ‾ + 2H + + SO42 ‾ → CO2 ↑ + H2O + 2Na + + SO42 ‾
CO32 ‾ + 2H + → CO2 ↑ + H2O
3) NaOH + HNO3 = NaNO3 + H2O
Na + + OH ‾ + H+ + NO3‾ → Na + + NO3‾ + H2O
OH ‾ + H+ → H2O
4) ZnCl2 + 4NH3 = [ Zn (NH3)4 ]Cl2
Zn 2+ + 2Cl ‾ + 4NH3 → [ Zn (NH3)4 ] 2+ + 2Cl ‾
Zn 2+ + 4NH3 → [ Zn (NH3)4 ] 2+
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Степень окисления – это условный заряд атома, вычисленный исходя из предположения, что все связи в веществе ионные (оно состоит только из ионов).
Значение степени окисления определяется числом электронов, смещенных от атома данного элемента к атому другого элемента (от менее ЭО к более ЭО элементу).
|
|
|
Ст.ок. может иметь „ - ”, „ + ” и нулевое значение.
Отрицательную степень окисления имеют атомы, которые приняли электроны от других атомов, т.е. в их сторону смещено связующее электронное облако.
Положительную ст.ок. имеют атомы, отдающие свои электроны другим атомам, т.е. связующее электр.облако оттянуто от них.
Определение ст.ок. проводят, используя следующие правила:
1. Ст.ок. элемента в простом веществе, например, в металле или в Н2,N2,О3 равна 0.
2. Ст.ок. элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду иона.
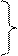 2+ - заряд иона для того, чтобы их
2+ - заряд иона для того, чтобы их
различить
+2 - ст.ок.
Na+1Cl ‾1
Mg+2Cl2‾1
Al3+F3‾1
3. В соединениях с ков. пол. связями „ - ” заряд относят к более электроотрицательному элементу, причем принимают следующ. ст.ок.:
а) для фтора ст.ок. = -1 во всех соединениях;
б) для кислорода ст.ок. = -2, за исключением Н2О2‾1 и в соединении с F: O+2 F2;
в) для водорода ст.ок. = +1, за исключением гидридов LiH, где ст.ок. = -1;
г) для щелочных и щелочно-земельных металлов – ст.ок. = +1; +2 соответственно.
4. Алгебраическая сумма ст.ок. атомов в соединении всегда равна 0, а всложном ионе – заряду иона.
Н3РО4
(+1) ·3 + х + (-2) ·4 =0 х = +5
↑ ↑
Ст.ок. число атомов
Cr2O7 2х + (-2) ·7 = -2 х = +6
Са3+2(Р+5О4‾2)2
Еще выделяют – высшая, низшая и промежуточная ст.ок.
Высшая ст.ок. прявл-ся, когда в образовании свяи принимают участие все валентные электроны. Численно она равна номеру группы.
Mn+7, S+6
Низшая ст.ок. – это наименьшее значение ст.ок. элемента, которое встречается в его соединениях. S-2
Все остальные ст.ок. элемента называют промежуточными. S+4
Зная ст.ок. элемента в соединении, можно предсказать, окислительные или восстановительные св-ва проявит это соединение.
|
|
|
S 2s22p4 S+6 2so2po S-2 2s22p6

H2S+6 O4 - S имеет высш. ст.ок. в этом соединении и => больше не может
отдавать е -, поэтому H2SO4 может быть только окислителем.
H2S-2 - низшая ст.ок., сера не может больше принимать е - и будет только восстановителем.
S+4 2s22po

H2S+4 O3 - промежуточная ст.ок., здесь может и отдавать и принимать е - => H2SO3 в зависимости от условий может проявлять как окислительные, так и восстановительные св-ва.
Особенно широко применяется понятие ст.ок. при изучении О-В Р.
Все хим. р-ции можно разделить на 2 типа. К первому типу относятся р-ции, протекающие без изменения ст.ок. атомов, входящих в состав реагирующих веществ.
H+1N+5O3-2 + Na+1O-2H-1 = Na+1N+5O3-2 + H2+1O-2
Ко второму типу относятся р-ции, идущие с изменением ст.ок. атомов реагирующих веществ.
K+1B-1 + Cl2o = Br2o + K+1Cl-1
Бром и хлор меняют свои ст.ок.
Окислительно-восстановительные реакции - реакции, протекающие с изменением ст.ок. атомов, входящих в состав реагирующих веществ.
О-В Р - самые распространенные и играют большую роль в природе и технике. С ними связаны дыхание и обмен веществ в живых организмах, фотосинтез.
Рассмотрим основные положения О-В Р.
1. Окислением наз-ся процесс отдачи электронов атомом, молекулой или ионом.
Alo - 3e - → Al+3 H2o - 2e - → 2H+ Fe+2 - e - → Fe+3
При окислении ст.ок. повышается.
2. Восстановлением наз-ся процесс присоединения электронов атомом, молекулой или ионом.
Fe+3 + e - → Fe+2
При восстановлении степень окисления понижается.
3. Восстановители - атомы, молекулы или ионы, отдающие электроны.
Во время р-ции они окисляются.
Окислители – атомы, молекулы или ионы, присоединяющие электроны. Во время р-ции они восстанавливаются. Т.к. атомы, молекулы и ионы входят в состав определен.
вещ-в, то и эти вещества соответственно наз-ся восстановителями и окислителями.
4. Процесс окисления не возможен без процесса восстановления и, наоборот, процесс восстановления всегда связан с процессом окисления. В одной р-ции одно вещ-во отдает е -, являясь восстановителем, другое – их принимает, являясь окислителем.
5. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем (число отданных е - = числу принятых е -).
|
|
|
Zno + So = Zn+2S-2

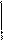 Zno - 2e - → Zn+2 2 1
Zno - 2e - → Zn+2 2 1
So + 2e - → S-2 2 1
Zno окисляется до Zn+2 Zno - восстановитель
So восстанавливается до S-2 So - окислитель
Процессы окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешн. Электрической цепи. Это схема – гальванический элемент, где на катоде идет процесс восстановления, а на аноде - процесс окисления.
Есть вещ-ва типичные окислители и типичные восстановители.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 631; Нарушение авторских прав?; Мы поможем в написании вашей работы!