КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Происхождение ненасыщенных жирных кислот в клетках организма, метаболизм арахидоновой кислоты
ЛЕКЦИЯ
по биохимии
для студентов 2 курса лечебного факультета
Тема: Патология липидного обмена
Время 90 минут
Учебные цели:
1.Сформировать представление о причинах, вызывающих патологию липидного обмена
2.Сформулировать понятия- а)Холестериноз;б)Холестеринопатии; в)Липидозы
Литература
1.Биохимия человека:, Р.Марри, Д.Греннер, П.Мейес, В.Родуэлл.- М.книга,2004.- т.1. -с.279-297.
2.Основы биохимии:А.Уайт, Ф.Хендлер,Э.Смит, Р.Хилл, И.Леман.-М. книга,
1981,т. 2,.-с.811-813.
3.Наглядная биохимия: Кольман., Рем К.-Г-М.книга 2004г.-с.170, 62,214.
4.Липиды, липопротеиды и атеросклероз: А.Н.Климов, Н.Г.Никульчева,,книга, Питер,1995г
5. Harper , s Biochemistry., 1996. by Appleton & Lange,-24- ed..,-p..282-291..
Материальное обеспечение
1.Мультимедийная презентация
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
| №п/п | Перечень учебных вопросов | Количество выделяемого времени в мин. |
| 1. | Биосинтез жирных кислот | 30 мин |
| 2. | Причины патологии липидного обмена | 30 мин |
| 3. | Атеросклероз и причины его вызывающие | 30 мин |
Всего 90 минут
Введение: Организм человека может накапливать жир даже при содержании на безжировой диете, насыщенной углеводами.
Вопрос1. Биосинтез жирных кислот
Наряду с расщеплением жирных кислот в результате их окисления, в клетках функционирует процесс синтеза жирных кислот. Путь синтеза жирных кислот не является обратным пути их расщепления. Он представляет собой новую последовательность реакций.

Схема перемещения ацетил-КоА из митохондрий в цитозоль
Основными особенностями пути биосинтеза жирных кислот являются следующие:
1. Синтез происходит в цитоплазме в отличие от распада, который протекает в матриксе митохондрий.
2. Промежуточные продукты синтеза жирных кислот ковалентно связаны с ацилпереносящим белком (АПБ), тогда как промежуточные продукты b-окисления жирных кислот связаны с коферментом А.
3. Большинство ферментов синтеза жирных кислот организованы в мультиферментный комплекс, называемый синтетазой жирных кислот.
4. Удлинение цепи синтезируемой жирной кислоты происходит путем последовательного присоединения двухуглеродных фрагментов. Поставщиком этих двухуглеродных фрагментов служит малонил-АПБ.
5. В качестве восстановителя при синтезе жирных кислот выступает НАДФН.
6. На этапе образования пальмитата (С16) удлинение остатка жирных кислот с участием мультиферментного комплекса синтетазы жирных кислот останавливается. Дальнейшее удлинение, как и введение двойных связей, происходят под влиянием других ферментных систем.
Синтез жирных кислот de novo происходит при наличии достаточного количества глюкозы, когда ацетил-КоА образуется больше, чем требуется для покрытия энергетических нужд. В этих условиях избыток моносахаридов, образовавшийся в результате переваривания углеводов, может запасаться не в форме водорастворимого гликогена, а в виде гидрофобных ТАГ.
Субстраты синтеза жирных кислот. Предшественником является ацетил-КоА, процесс протекает в цитозоле. Ацетил-КоА образуется из пирувата под действием митохондриального пируватдегидрогеназного комплекса. Но внутренняя митохондриальная мембрана непроницаема для ацетил-КоА. В митохондриях фермент цитратсинтаза катализирует реакцию образования цитрата из ацетил-КоА и ЩУК. Цитрат выходит из митохондрий в цитоплазму. В цитозоле фермент АТФ-цитратлиаза расщепляет цитрат до ацетил-КоА и ЩУК (см рис). Этот ацетил-КоА и принимает участие в синтезе жирных кислот.
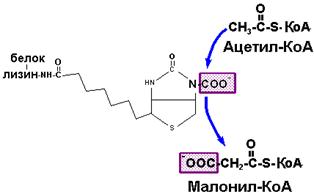
Ферменты синтеза жирных кислот. В биосинтезе насыщенных жирных кислот участвуют два ферментных комплекса: ацетил-КоА карбоксилаза и ацилсинтетаза. В случае синтеза пальмитиновой кислоты необходимы 8 молекул ацетил-КоА, 14 НАДФН (в качестве восстановительных эквивалентов) и 7 АТФ. Первая молекула ацетил-КоА действует как включатель ацилсинтетазы. Остальные двухуглеродные фрагменты вовлекаются в процесс после того, как молекула ацетил-КоА превращается в малонил-КоА под действием ацетил-КоА карбоксилазы.
Ацетил-КоА карбоксилаза, содержащая в качестве простетической группы биотин (витамин Н), катализирует ключевую реакцию в синтезе жирных кислот. Эта реакция выглядит следующим образом:


| 
|
| Механизм действия ацетил КоА карбоксилазы |
Имеется несколько механизмов регуляции активности ацетил-КоА карбоксилазы. Есть мономерная (неактивная) и полимерная (активная) формы фермента. Цитрат активирует фермент за счет увеличения образования полимерной формы, содержащей около 20 мономерных субъединиц. Ацетил-КоА карбоксилаза подвергается обратимому фосфорилированию/дефосфорилированию; цАМФ-зависимая протеинкиназа ингибирует ферментативную активность, а фосфатаза - активирует. На этом основана гормональная регуляция активности ацетил-КоА карбоксилазы. Повышенные концентрации малонил-КоА и ацил-КоА аллостерически ингибируют активность этого фермента.
Синтетаза жирных кислот - это мультиферментный комплекс, включающий в себя 7 ферментов и белок, содержащий в своем составе 4-фосфопантотеиновую простетическую группу. Суммарная молекулярная масса этого комплекса, находящегося в цитоплазме клеток, составляет около 400 тыс.Да. Центральное место в этой системе занимает ацилпереносящий белок, с которым ковалентно связываются промежуточные продукты биосинтеза жирных кислот.
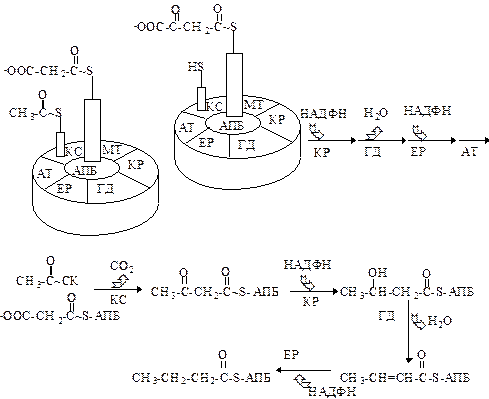
Роль простетической группы в АПБ выполняет фосфопантотеин, который также входит в состав кофермента А. Функция АПБ в биосинтезе жирных кислот аналогична функции кофермента А в окислении жирных кислот. В процессе построения цепи жирной кислоты промежуточные продукты образуют эфирные связи с АПБ. Белок является своеобразной сердцевиной комплекса и функционирует как переносчик промежуточных продуктов в растущей цепи ацила. Синтез инициируется праймером (первой молекулой ацетил-КоА), с которой взаимодействует малонил-КоА, при этом выделяется СО2 и образуется ацетоацетильный фрагмент. Последний восстанавливается при участии НАДФН+Н+ и после отщепления воды превращается в еноильный остаток. Этот остаток вновь восстанавливается при участии НАДФН+Н+ в остаток масляной кислоты.
Началом последующего цикла, который включает в себя ту же последовательность реакций, является конденсация бутирил-АПБ с следующей молекулой малонил-АПБ. Добавление каждого двухуглеродного фрагмента в растущую ацильную цепь сопровождается циклом реакций конденсации, восстановления (используется НАДФН), дегидратации и восстановления (используется вторая молекула НАДФН). За 7 таких циклов образуется насыщенная жирная кислота с 16 углеродными атомами. В общем виде это выглядит следующим образом:
ацетил~КоА + 7 малонил~КоА + 14 НАДФН + 14 Н+ ¾> пальмитат + 7 СО2 + 14 НАДФ + 8 КоА-SH + 6 Н2О
Потребность в НАДФН для реакций восстановления в процессе синтеза жирных кислот. НАДФН+Н+, который необходим для восстановительных реакций, протекающих в ходе биосинтеза жирных кислот, в различных клетках поступает из двух различных источников. В печени НАДФН+Н+ образуется, главным образом, в реакциях пентозофосфатного пути. В клетках жировой ткани НАДФН образуется преимущественно за счет функционирования челночного механизма, обеспечивающего перенос остатка уксусной кислоты из митохондрий в цитоплазму. Последний протекает с участием фермента малатдегидрогеназы (кофермент НАДН) и малик фермента (в реакции восстановления НАДФ) (схему см. выше).
Как уже отмечалось, при участии синтетазы жирных кислот идет образование ацилов, содержащих максимально 16 углеродных атомов. Дальнейшее удлинение цепей жирных кислот происходит при помощи других ферментных систем путем присоединения ацетильных групп; этот процесс протекает в эндоплазматическом ретикулуме и митохондриях. Скорость биосинтеза жирных кислот определяется, главным образом, скоростью ацетил-КоА-карбоксилазной реакции.
Незаменимые и заменимые - Среди ненасыщенных жирных кислот в организме человека не могут синтезироваться w-3 и w-6 жирные кислоты в связи с отсутствием ферментной системы, которая могла бы катализировать образование двойной связи в положении w-6 или любом другом положении, близко расположенном к w-концу. К таким жирным кислотам относятся линолевая кислота (18:2, D9,12), линоленовая кислота (18:3, D9,12,15) и арахидоновая кислота (20:4, D5,8,11,14). Последняя является незаменимой только при недостатке линолевой кислоты, поскольку в норме она может синтезироваться из линолевой кислоты.
У человека при недостатке в пище незаменимых жирных кислот описаны дерматологические изменения. Обычный рацион взрослых людей содержит достаточное количество незаменимых жирных кислот. Однако у новорожденных, которые получают рацион, обедненный жирами, отмечаются признаки поражения кожи. Они проходят, если в курс лечения включается линолевая кислота. Случаи подобного дефицита наблюдаются и у пациентов, которые длительное время находятся на парентеральном питании, обедненном незаменимыми жирными кислотами. В качестве профилактики такого состояния достаточно, чтобы в организм поступали незаменимые жирные кислоты в количестве 1-2% от общей калорической потребности.
Синтез ненасыщенных жирных кислот из насыщенных с параллельным удлинением цепи. Десатурация проходит под действием микросомального комплекса ферментов, состоящего из трех компонентов белковой природы: цитохрома b5, цитохром b5-редуктазы и десатуразы, которые содержат в своем составе негемовое железо. В качестве субстратов используются НАДФН и молекулярный кислород. Из этих компонентов образуется короткая цепь переноса электронов, с помощью которой на короткий период времени в молекулу жирной кислоты включаются гидроксильные группы. Затем они отщепляются в виде воды, в результате в молекуле жирной кислоты формируется двойная связь. Имеется целое семейство субъединиц десатуразы, которые специфичны к определенному месту введения двойной связи.
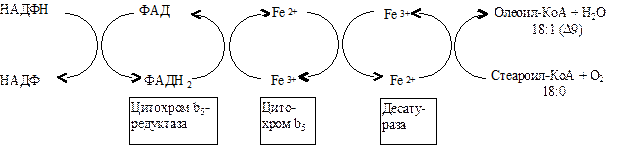
Элонгация происходит путем добавления двухуглеродного фрагмента к карбоксильному концу жирной кислоты. Имеется две раздельных системы элонгации в микросомах и митохондриях. В микросомальной системе элонгации в качестве донора двухуглеродной группировки используется малонил-КоА, а в митохондриальной системе - ацетил-КоА. Введение двухуглеродного фрагмента включает две реакции восстановления (используются 2 молекулы НАДФН) и последовательность других реакций, описанных в разделе “синтез жирных кислот”.
В качестве примера можно привести последовательность превращений синтеза арахидоновой кислоты из линолевой кислоты:
18:2(D9,12)
| 18:3(D6,9,12) | 20:3(D8,11,14) | 20:4(D5,8,11,14) |
Специфическое значение полиненасыщенных жирных кислот для организма заключается в том, что они придают жидкостность клеточным мембранам, а также являются предшественниками эйкозаноидов. С другой стороны, двойные связи являются центрами перекисного окисления жирных кислот свободными радикалами. Образующиеся продукты, накапливаясь в клетке, приводят к её повреждению.
Вопрос.2. Патология липидного обмена.
Патология липидного обмена возникает по двум причинам:
а) при нарушении переваривания и всасывания липидов;
б) при нарушении метаболизма липидов и липопротеидов.
В основе нарушения переваривания и всасывания липидов лежат три группы патологических процессов:1) в поджелудочной железе, сопровождающиеся дефицитом панкреатической липазы; 2) в печени- при закупорке желчных протоков и фистуле желчного пузыря, приводящие к дефициту желчи; 3) в кишечнике, сопровождающиеся снижением метаболической активности слизистой оболочки, где локализованы ферменты синтеза ТГ. В соответствии с этим различают панкреатическую, гепатогенную и энтерогенные формы стеаторей. Стеаторея- нарушение переваривания жиров.
Панкреатическая стеаторея вызывается дефицитом панкреатической липазы, что наблюдается при хроническом панкреатите, врожденной гипоплазии пакреас и муковисцедозе, когда наряду с другими железами поражена и поджелудочная железа.
Гепатогенная стеаторея наблюдается при врожденной атрезии желчных путей, механических желтухах, гепатитах, циррозе.
Энтерогенная стеаторея отмечается при целиакии, абеталипопротеинемии, интестинальной лимфангиэктазии, интестинальной липодистрофии, амилоидозе и обширной резекции тонкого кишечника.
При переваривании пищевых жиров в пищеварительном тракте высвобождаются моноглицериды и высшие жирные карбоновые кислоты (ВЖК)., которые после всасывания образуют ТГ. Последние являются основными компонентом хиломикронов (ХМ). Липиды, являясь гидрофобными, транспортируются кровью в виде особых надмолекулярных образований- липопротеидов(ЛП), в состав которых входят ХС, ТГ, ФЛ (фосфолипиды) и апобелки.
Диагностическое значение имеет определение в крови содержания ТГ, СЖК, ХС, желчных кислот, ФЛ и ЛП а также состав последних. При переваривании пищи, в пищеварительном тракте высвобождается большое количество ТГ и ВЖК, которые после всасывания в слизистой кишечника образуют ресинтезированные липиды, Являясь экзогенными по своей природе, эти ресинтезированные ТГ, встраиваются в ХМ и через грудной лимфатический проток попадают в большой круг кровообращения. Это относится к ЖК, содержащим > 10-12 атомов С.Жирные кислоты с короткими цепями непосредственно попадают в портальный кровоток и далее в печень, где они наряду с эндогенными (синтезированными в печени ТГ) встраиваются в пре-бетаЛП-ЛПОНП.
Холестерин- составная часть клеточных мембран и ЛП, особенно ЛПНП.
Независимо от происхождения, свободный ХС встраивается в липидные мицеллы, включающие СЖК, желчные кислоты и лизолецитин.. Мицеллы отдают свободный ХС клеткам слизистой оболочки кишечника, где экзогенный ХС смешивается с эндогенным и подвергается частичной эстерификации холестеринэстеразой. Далее ХС секретируется в лимфу, где появляется в составе ЛПОНП и ХМ. В крови он переходит из ЛПОНП в ЛПНП. Окисление ХС это его единственный путь его необратимого удаления из организма, т.е. из мембран и ЛП-комплексов., и этот процесс характерен не для всех типов клеток. Оксигеназные системы находятся в клетках печени и органов, синтезирующих стероиды.
Окисление ХС идет двумя путями: за счет биосинтеза желчных кислот и биосинтеза стероидных гормонов. Первый путь окисляет от 60-80% всего ежедневно, образующегося в организме ХС, второй путь- всего2-4 %. Монооксигеназный путь окисления при участии цитохрома Р450. Желчегенез ускоряется при гиперхолестеринемии и снижается у больных атеросклерозом.
Холестерин в патологии. В основу классификации холестериноза (накопления ХС) и холестеринопатий положен принцип содержания ХС в целом организме, крови, в отдельных органах
| Содержание ХС в мембранах клеток | Содержание ХС в крови | Содержание ХС в отдельных органах, тканях |
| Повышенное содержание ХС в мембранах-неосложненное течение-физиологическое старение | Дислипопротеинемия-изменение соотношения классов липопротеидов | Липидозы |
| Осложненное течение -атеросклероз | Гиперлипопротеинемия (ГЛП), классификация ВОЗ | |
| Пониженное содержаниеХС в мембранах: а)канцерогенез;б)вирусные инфекции | Гипопротеинемия |
Тип 1. (изменение содержания ХС в организме)
1.Холестериноз:- накопление ХС
а) неосложненный (физическое старение, старость, смерть)- накопление ХС в плазматических мембранах, как результат снижения стероидогенеза (секс-гормонов);
б) осложненный (атеросклероз) в форме ИБС (инфаркт миокарда, кардиосклероз), ишемии мозга (инсульт, тромбоз), ишемии конечностей (гангрена), ишемии органов и тканей, дегенерации брадитрофных структур (катаракта, остеохондроз), связанный с уменьшением желчегенеза.
2. Дефицит ХС:
А) злокачественные новообразования, сопровождаются гипоХС, с низким содержанием ХС в плазматических мембранах клеток.;
Б) вирусные инфекции сопровождаются гипоХС, повышенной проницаемостью плазматических мембран для вирусов
ТИП 2. Дислипопротеинемии-изменение соотношения классов ЛП в крови. – это гипо и гиперхолестеринемии. Это первичные наследственные гипо и приобретенные вторично состояния. (Классификация по Фредриксону)
ТИП 3. Накопление ХС в отдельных органах и тканях
Атеросклероз. В этиологии атеросклероза ведущая роль принадлежит риск-факторам, в частности артериальной гипертензии, эмоциональной лабильности, курению, гиперТГ-демии. Сферу этих факторов можно ограничить, если выделить три категории больных, в одной из которых влияние этих факторов в развитии атеросклероза действительно велико, а в другой несущественно.
Первая группа- это лица, устойчивые к развитию атеросклеротических изменений.. Содержание ХС у них в крови меньше 5.2 ммоль/л и частота атеросклротических изменений МИНИМАЛЬНА. К этой группе относятся долгожители с наследственной гипобеталипопротеидемией (отсутствие ЛПНП в крови) или семейным дефицитом ЛПВП. Даже полное отсутствие ЛПВП не приводит к развитиюатеросклеротических изменений сосудов эласто-мышечного типа. Действие факторов риска на эту популяцию не приводит к развитию атеросклероза.
Вторая группа-это люди с содержанием ХС от 5.2-до 9 ммоль/л, т.е. основная часть взрослого населения. Влияние факторов риска в этой группе является решающимпри образовании атеросклеротических изменений и появления атеросклероза любой локализации. Большую роль в диагностике заболеваний играет холестериновый индекс атерогенности, когда высокая концентрация ХС в ЛПНП, на фоне низкого содержания ЛПВП является плохим прогностическим признаком. Отдельные факторы риска влияют на развитие атеросклероза в различной степени.
Третью группу составляют лица с концентрацией ХС в плазме выше, чем 9 ммоль/л. Это больные атеросклерозом и отсутствие атеросклеротических изменений сосудов при такой концентрации ХС в крови встречается крайне редко. Следует отметить, что подавляющее большинство людей принадлежит ко 2 группе. Поэтому ограничение сферы деятельности других факторов за исключением ХС, определнной популяции людей, переводит стероид из категории способствующих, в категорию причинных.

Появление и развитие атеросклеротических изменений рассматривается с позиций инфильтрационной теории, согласно которой основным действующим фактором, вызывающим образование и развитие атеросклеротических изменений в стенке сосуда является ХС ЛПНП.Этот класс ЛП подвергается значительным изменениям в зависимости от питания, условий внешней и внутренней среды. Меняется не только липидный, но и апопротеиновый состав, заряд, жесткость ЛП- частицы. При этом заметно нарастает содержание иммуноглобулина LgG.
Апо-В содержащие ЛП (ЛПНП и ЛПОНП) образуют растворимые комплексы с ГАГ соединительнотканного матрикса аретрий, приводя к структурным изменениям стенки сосуда.
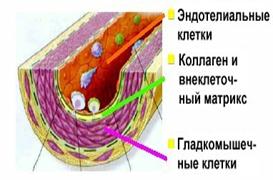

Строение артериальной стенки Дисфункция эндотелия
Такое изменение структуры и конформации ЛП вызывает активацию перекисного окисления липидов, входящих в состав ЛП. Экзогенные вещества (например жирорастворимые витамины), также как и перекиси липидддов, могут с одной стороны вызывать конформационные изменения апоаротеинов, а сдругой служить гаптенамит. Не исключено появление в составе ЛП фенотипов апопротеинов или их мутантных форм. Антитела к ЛП появляются в 2х случаях: в отвте на модифицированные in vivo ЛП, которые приобретают аутогенные свойства, и, во-вторых в ответ на воздейтсвие патогенных или других факторов, когда клетки иммунокомпетентной системы синтезируют антитела, образующие иммунные комплексы с нативными плазменными ЛП. В обоих случаях образуется иммунный комплекс ЛП-антитело, который рассматривается как модифицированный ЛП, иначе реагирующий с клеткой, чем нативный ЛП.
Физиологический смысл формирования иммунного комплекса необходим для более быстрого удаления антигена из крови. Иммунный комплекс ЛПНП-LgG захватывается макрофагами на 23% активнее, чем нативные ЛП. Избыточный захват иммунных комплексов ЛП- антитело макрофагами приводит к превращению последних в пенистые клетки, играющие важную роль в развитии атеросклеротичесмких поражений артерий (ксантоматоз, регрессирование и стадии атеросклероза).
Появление пенистых клеток во внутренней оболочке артерий является характерным морфологическим признаком прогрессирующего атеросклеротического процесса. Ускоренному образовании. Пенистых клеток способствует специфический набор рецепторов, у макрофагов интимы артериальной стенки. Это:
1.апо-В рецепторы к ЛПОНП и ЛПНП
2. рецепторы к ЛПОНП и ЛППП
3.рецепторы к комплексу ЛПОНП с ГАГ
4.рецепторы к комплексу белок- эф.ХС
5. рецепторы к иммунным комплексам ЛП-иммуногобулин LgG
6. рецепторы, связывающие модифицированные ЛП- сукцинилированные и ацетоацетилированные
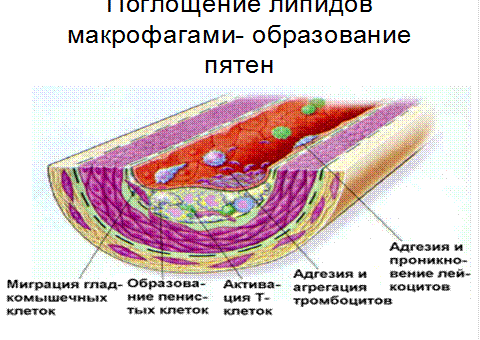
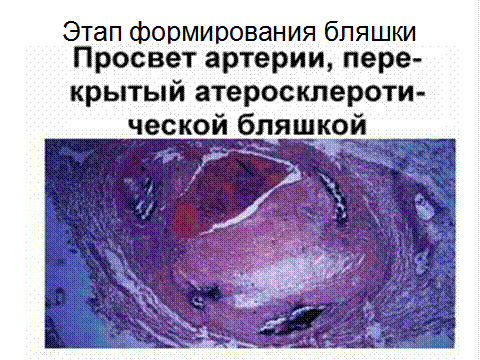
Гибель пенистых клеток приводит к выходу в межклеточное пространство липидов. Таким образом липидоз интимы происходит одновременно как за счет ЛП, поступающих их плазмы, так и за счет освобождения из пенистых клеток ХС. Накопление последних сопровождатеся очаговым склерозом, образованием пятен и полос, являющихся основой для фиброзных бляшек.
Осложненные поражения сопровождаются развитием воспалительных, дегенеративных и некротических изменений в атеросклеротических бляшках. Дальнейшее разрастание СТ, увеличение размеров бляшки, утолшение интимы, образование изъязвлений с выходом детрита в кровоток, геморрагии в бляшку, возникновение тромбов, кальциноз.
Существенную роль в появлении ишемического синдрома при атеросклерозе имеет поражение клеток крови. Увеличение содержания ХС в мембране эритроцитов приводит к изменению ее физико-химических свойств и нарушению функции мембранно-связанных ферментов. Одновременно с индексом ХС/ФЛ увеличивается микровязкость и скрость агрегации тромбоцитов.. При этом снижается активность Na+ K+ АТФ-азы, увеличиваются размеры эритроцитов, деформируемость клеток падает. Тромбоциты также накапливают ХС, скорость их агрегации также возрастает, мембрана становится более регидной. Такие же изменения характерны и для лимфоцитов.
Нарушение реологических свойств крови наряду с изменением микрососудов при холестеринозе обуславливает нарушение микроциркуляции и связанную с этим ишемию. Результатом этого является тромбоз, ишемия, склероз и некроз.
Должность и ф.и.о. автора лекции
Дата
.
[3] Значение ЛХАТ для обмена ЛП хорошо прослеживается при заболевании, связанной с врожденной недостаточностью этого фермента у человека. При нем активность ЛХАТ в плазме полностью отсутствует. В результате в плазме присутствуют необычные липопротеины, обогащенные СХ. ЛПВП лишены ЭХ и имеют дискообразную форму. СХ накапливается в плазматических мембранах клеток: эритроцитов, клеток почек, селезенки, роговицы глаза.
Поэтому у таких больных часто наблюдается почечная недостаточность с вторичной гипертриацилглицеролемией, гипохромная анемия, спленомегалия, помутнение роговицы.
Организационно- методические указания лаборантскому составу Подготовить мультимедийную презентацию лекции в Power Point и flash проекциях
Лекция подготовлена доц. каф. Свергун В.Т. Дата-
[4] ЛПБ был открыт в 1976г. Это гликопротеин с молекулярной массой около 70 кДа. Белок может переносить также ФЛ. Однако эта способность у него выражена в гораздо меньшей степени, чем по отношению к ЭХ. ЛПБ не может транспортировать СХ. Предполагается два механизма действия этого белка. Согласно первой гипотезе ЛПБ выступает в качестве растворимого переносчика ЭХ, усиливая степень диффузии этих липидов между различными липопротеинами. Тем самым комплекс с ЛПБ с липидами выступает в
качестве стабильного промежуточного продукта транспортной реакции. В соответствии с другим механизмом ЛПБ образует часть молекулярного комплекса между донором (ЛПВП) и акцептором (ЛПОНП, ЛПНП). Там он выступает в качестве своеобразного молекулярного мостика между частицами донора и реципиента. За счет этого ускоряется молекулярный транспорт липидов между соединенными поверхностями ЛП. Активность ЛПБ ингибирует специальный белок плазмы крови. Действие ингибитора заключается в отщеплении ЛПБ от связывающих центров на липопротеиновых частицах.
Фермент синтезируется в гепатоцитах, но активным становится на поверхности эндотелиальных клеток печеночных капилляров. Секреция гепатоцитами ПЛ возможна только тогда, когда от углеводной части у N-конца его полипептидной цепи отщепится остаток глюкозы Этот фермент обнаружен также в половых железах и других органах, в которых образуются стероидные гормоны. Туда он поступает из плазмы для последующего своего катаболизма. Как и ЛПЛ печеночная липаза относится к сериновым гидролазам и способна связывать гепарин. Фермент катализирует гидролиз ТГ, с отщеплением радикалов жирных кислот в a и g - положениях, ди- и моноацилглицеролов, фосфолипидов. В отличие от ЛПЛ печеночная липаза не активируется апо С-2 и катализирует реакции трансацилирования. К примеру:
|
|
Дата добавления: 2014-01-05; Просмотров: 1072; Нарушение авторских прав?; Мы поможем в написании вашей работы!