
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния газа. Уравнение Менделеева-Клапейрона
|
|
|
|
Закон Авогадро.
В отношении идеальных газов, а также газов и паров, близких к этому состоянию, установлен следующий закон Авогадро: при данных условиях температуры и давления в равных объемах всех газов содержится одинаковое число молекул.
Одно из важнейших следствий из этого закона: грамм-молекулы всех веществ в газообразном или парообразном состоянии при нормальных физических условиях занимают одинаковые объемы, а именно: 22,4 л/моль, или 22,4 м3/кмоль, или 22,4 см3/миллимоль.
Нормальные физические условия: температура 0° С (или 273° по абсолютной шкале = 273° К), давление 760 мм ртутного столба.
Из закона Авогадро вытекают также следующие два положения:
1. Молекулярная масса вещества М численно равна удвоенной его плотности D в газообразном или парообразном состоянии по водороду: М = 2D, точнее, М = 2,016 D).
2. Молекулярная масса вещества численно в 29 раз больше, чем относительная плотность его D' в газообразном или парообразном состоянии по отношению к воздуху: М = 29 D'.
В этих формулах:
D = Вес 1 л данного газа; D' = Вес 1 л данного газа (1-1)
Вес 1 л водорода Вес 1 л воздуха
При нормальных условиях 1 л водорода весит 0,09 г, а 1 л воздуха— 1,293 г.
Из формулы М = 29D' получаем: D' = М/29. Из последнего соотношения вытекает, что все газы и пары, у которых М > 29, тяжелее воздуха, а у которых М < 29—легче воздуха.
Выше приводились данные в отношении газов, находящихся при нормальных физических условиях (температура 0°, давление 760 мм рт. ст.). На практике большей частью приходится вести работу с газами, находящимися при иных условиях температуры и давления.
Для производства расчетов с газами, находящимися при разнообразных физических условиях, служит уравнение Клапейрона — Менделеева, которое в математической форме устанавливает связь между величинами (параметрами), определяющими состояние газа,— объемом, давлением и температурой:
|
|
|
pV = nRT. (1-2)
В этой формуле р — давление газа, выраженное либо в мм рт. ст., либо в атм; V — объем газа в л; п —число молей газа; R — универсальная газовая постоянная; Т —абсолютная температура, которая связана со шкалой Цельсия равенством:
Т = t + 273, где t — температура по шкале Цельсия.
Число молей газа п может быть вычислено по одному из соотношений:
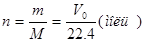 (1-3)
(1-3)
где m —данная масса газа в г; М —r-молекулярное количество газа, согласно его химической формуле, также в г; Vo — объем данной массы газа при нормальных условиях в л.
Универсальная газовая постоянная R вычисляется для 1 моля газа, находящегося при нормальных условиях:
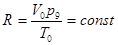 (1-4)
(1-4)
В последней формуле р0 — нормальное давление (р0 = 760 мм рт. ст. == 1 атм), V0 —молярный объем газа при нормальных условиях (Vo = 22,414 л/моль) и То—нормальная температура (для t = 0°С имеем Т0=273°К).
Численная величина газовой постоянной R зависит от того, в каких единицах выражаются объем и давление газа. Если объем выражен в литрах (Vo = 22,414 л/моль), а давление в атмосферах (р0 — 1 атм), то для газовой постоянной получаем:
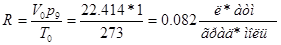 (1-5)
(1-5)
Если объем газа по-прежнему выражен в литрах, а давление в миллиметрах ртутного столба {р0 = 760 мм рт. ст.), то газовая постоянная окажется равной:
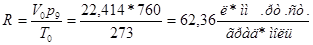 (1-6)
(1-6)
Газовая постоянная имеет размерность работы (представляет собой работу расширения 1 моля газа при нагревании его на 1°-при постоянном давлении). В связи с этим величину R можно выражать и в других энергетических единицах.
Литература:
1. Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
2. Т.Браун. Химия – в центре наук / Браун.Т, Лемей Г.Ю. – М.: Мир, 1983. – тт. 1–2.
|
|
|
3. Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
4. Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
5. Кузьменко Н.Е. Краткий курс химии / Н.Е. Кузьменко, В.В Еремин, В.А. Попков. – М.: Высшая школа, 2002. – 415 с.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 771; Нарушение авторских прав?; Мы поможем в написании вашей работы!