
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислоты
|
|
|
|
Определение кислот с точки зрения теории электролитической диссоциации было дано ранее (см. § 6.5). Дальнейшее развитие химии потребовало уточнить и дополнить определения кислот и оснований.
Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием – вещество, способное принимать протоны. Любая реакция отщепления протона выражается уравнением
Кислота → основание + Н+
На базе таких представлений понятными становятся основные свойства аммиака, который за счет неподеленной пары электронов атома азота эффективно принимает протон при взаимодействии с кислотами, образуя за счет донорно-акцепториой связи ион аммония:
HNO3 + NH3 = NH4+ + NO3-
кислота основание основание кислота
Еще более общее определение кислот и оснований. Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия AlF3 – кислота, способная принимать электронную пару при взаимодействии с аммиаком:
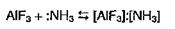
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В только что рассмотренном примере аммиак является основанием.
Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями. В таблице сопоставлены различные определения кислот и оснований, используемые в настоящее время.
|
|
|

Номенклатура и классификация кислот. Поскольку существуют различные определения кислот, то их классификация и номенклатура довольно условны.
По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные (например, HF, HNО2), двухосновные (Н2СО3, H2SO4) и трехосновные (Н3РО4).
По составу кислоты делят на бескислородные (HCI, H2S) и кислородсодержащие (НСlО4, НClО3).
Обычно названия кислородных кислот производятся от названия неметалла с прибавлением окончаний -ноя, -вал, если степень окисления неметалла равна номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:

Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания -водородная:
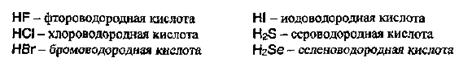
Если рассмотреть полярность связи водород — элемент в пределах периода, то легко можно связать полярность этой связи с положением элемента в периодической системе. От атомов металлов, легко теряющих валентные электроны, атомы водорода принимают эти электроны, образуя устойчивую двухэлектронную оболочку типа оболочки атома гелия, и дают ионно построенные гидриды металлов.
Атомы элементов III-IV групп — бор, алюминий, углерод, кремний — образуют с атомами водорода ковалентные, слабо полярные связи, не склонные к диссоциации. Однако с ростом заряда атома в пределах периода, т.е. для элементов V-VII групп, полярность связи элемент-водород вновь увеличивается, но характер распределения зарядов в возникающем диполе иной, чем для элементов, склонных к потере электронов. Атомы неметаллов, у которых для завершения электронной оболочки необходимо несколько электронов, оттягивают (поляризуют) к себе пару электронов связи тем сильнее, чем больше заряд ядра. Поэтому в рядах СН4 - NH3 - Н2O - HF или SiH4 - РН3 - H2S - НСl связи атомов водорода, оставаясь ковалентными, приобретают более полярный характер, а атом водорода в диполе связи элемент-водород становится более электроположительным. Если полярные молекулы оказываются в полярном растворителе, то может происходить процесс электролитической диссоциации.
|
|
|
Как уже указывалось, оксид водорода — вода Н2О — сам способен к процессам частичной диссоциации 2Н2О = Н3О+ + ОН-. Естественно предположить, что водородные соединения элементов IV-V групп будут менее склонны к диссоциации, и в водных растворах всегда будет присутствовать более диссоциированное по связи Э-Н (С-Н, N-H, Р-Н) соединение — вода. И действительно, соединения элементов IV-V групп с металлами, в которых имеются ионные связи Э-металл, разрушаются водой, проявляющей в данном случае роль сильной кислоты по отношению к соответствующимводородным соединениям и их анионам:
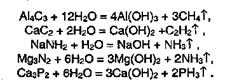
Напротив, для водородных соединений элементов VI и VII групп связь Э-Н будет не менее полярна, чем в молекулах воды, и они смогут диссоциировать по этой связи, причем образующийся ион водорода обратимо переходит на электронную пару воды с образованием иона гидроксония:
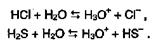
Ионный разрыв связи Э-Н протекает тем легче, чем больше размер атома, поэтому в ряду галогеноводородных кислот сила кислот возрастает от HF к HI.
У кислородсодержащих кислот наблюдается аналогичная картина, их специфика заключается в том, что во всех этих кислотах имеется связь Н-О-Э и естественно, что под влиянием связи О-Э будет меняться полярность связи Н-О. В большинстве случаев она выше полярности связи Н-О-Н а тем более связи Н-О-металл. Поэтому эти кислоты диссоциируют, как правило, легче, чем вода:
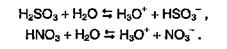
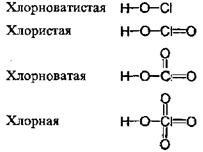 На нескольких примерах рассмотрим чрезвычайно важную особенность кислородсодержащих кислот, образованных элементами, способными проявлять различную степень окисления. Хорошо известно, что хлорноватистая кислота HClO является очень слабой кислотой, НСlO2 — также слабая, но сильнее хлорноватистой, НСlO3 — сильная кислота. Хлорная кислота НСlO4 — самая сильная из кислот в этом ряду и одна из самых сильных среди всех неорганических кислот. Рассмотрим структурные формулы этих кислот.
На нескольких примерах рассмотрим чрезвычайно важную особенность кислородсодержащих кислот, образованных элементами, способными проявлять различную степень окисления. Хорошо известно, что хлорноватистая кислота HClO является очень слабой кислотой, НСlO2 — также слабая, но сильнее хлорноватистой, НСlO3 — сильная кислота. Хлорная кислота НСlO4 — самая сильная из кислот в этом ряду и одна из самых сильных среди всех неорганических кислот. Рассмотрим структурные формулы этих кислот.
Для диссоциации по кислотному типу необходим разрыв связи О-Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO - НСlO2 – НсlO3 - НСlO4? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи О-О оттягивается некоторая доля электронной плотности. В результате этого часть электронной плотности оттягивается и от связи О-Н, которая за счет этого ослабляется.
|
|
|
Такая закономерность — усиление кислотных свойств с возрастанием степени окисления центрального атома — характерна не только для хлора, но и для других элементов. Например, азотная кислота HNO3, в которой степень окисления азота равна +5, является более сильной кислотой, чем азотистая кислота НNO2 (степень окисления азота +3); серная кислота H2SO4 (S+6) — более сильная, чем сернистая кислота H2S03 (S+4).
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1269; Нарушение авторских прав?; Мы поможем в написании вашей работы!