
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
Буферные растворы
Ионное произведение воды. рН раствора.
Особенности воды как электролита.
Особенности воды как растворителя связаны с особенностями её электронного строения и наличием между молекулами воды водородных связей. Молекула воды является полярной и имеет высокий дипольный момент. Высокий дипольный момент воды определяет высокую дтэлектрическую проницаемость воды. Это значит, что такие соединения как аммиак, диоксид углерода, серный оксид при растворении в воде являются электролитами.
С позиции протолитической теории кислота – молекула, ион или др. частица, которая отдает электрон; основание – частица, которая принимает. Вода диссоциирует так:
H2O + H2O ↔ OH- + H3O+ характеризует ионное про-
к-та осн-е
Крав = СОН- • СН + изведение воды(1атм,25оС)
H2O ↔ H+ + OH- СН2О
Крав • СН2О = СОН- • СН+ ≈ 10-14
Это равновесие сохраняется при добавлении к воде кислоты или щелочи, меняется только соотношение H+ и OH-.
СН+ = СОН- = 10-7моль/л – рН = 7 – нейтральная реакция
СН+ > СОН- 10-1 – 10-6 моль/л – кислая реакция
СН+< СОН- 10-8 - 10-13моль/л щелочная реакция
Для определения кислотности растворов введена величина рН.
рН=-lgCH+
0,01моль/л 0,01моль/л
Пример: HNO3→H++NO3-; рН=-lg 10 -2= 2
10 -3моль/л 10 -3моль/л
Щелочь: NaOH→Na++OH-; рОН=-lg 10 -3=3 (рН=14-рОН) рН=14-3=11
При вычислении рН слабых электролитов следует учитывать их Кдис.
Шкала водородных показателей:
рН=7-нейтральная среда
рН<7-кислая среда
рН>7-щелочная среда.
Чаще всего при добавлении к воде кислоты или щелочи, то произойдет значительное изменение рН, но есть растворы, при добавлении к которым к которым 90% кислоты или щелочи (к 1 л р-ра) – рН смещается лишь в сотых долях- это растворы, представляющие собой смеси слабых кислот с солью с одноименным анионом, или слабого основания с солью с одноименным катионом такие растворы - буферные растворы.
Буферные растворы:
CH3COOH+CH3COONa – ацетатный буфер
NH4OH+NH4Cl – аммонийный
NaH2PO4+Na2HPO4 – фосфатный.
Буферные растворы – практически не меняютрН при добавлении к ним кислоты или щелочи.
Пример: CH3COOH+CH3COONa – ацетатный буфер (рН≈5,3)
а) + HCl – кислота: CH3COONa+ HCl→ CH3COOH+ NaCl
б) + NaOH- щелочь: CH3COOH+ NaOH→ CH3COONa+ H2O
Т.о. буферная система поддерживает определенное значение рН р-ра.
В организме человека действует 4 буферных системы: Карбонатная, фосфатная, аминокислотная и белковая.
Но добавление кислоты или щелочи не безразмерно. Каждая буферная система характеризуется собственной буферной емкостью – β
β=кол-во молей кислот добавл к 1 л буфера /Δ рН на 1
Буферные растворы в химии применяются, например, при определении натрия в крови.
Расчёт концентрации ионов водорода в растворах
Гидролиз – обменная реакция вещества с водой. Гидролиз солей – реакция соли с водой, приводящая к образованию слабой кислоты или слабого основания. Схема гидролиза: Км++НОН↔КОН(м-1)++Н+
Ан-+НОН↔НА(н-1)-+ОН-
Гидролиз обусловлен образованием слабой кислоты НА(н-1)- или слабого основания КОН(м-1)+.
Соли, образованные анионом сильной кислоты и катионом слабого основания, гидролизу не подвергаются.
Возможны три варианта гидролиза солей: по катиону, по аниону и по катиону и аниону одновременно.
1. Гидролиз по аниону – ему подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (К2СО3, Na2S, Na2SО3, CH3COONa и т.д.).
В данном случае при гидролизе – щелочная среда (рН>7).
Пример:
CH3COONa + НОН↔ CH3COOН+ NaOH
CH3COO-+ НОН↔CH3COOН+ОН-
Для многозарядного аниона – протекает ступенчато.
1 ступень Na2SО3+ НОН ↔ NaНSО3+ NaOH
SО32-+ НОН ↔ НSО3-+ ОН-
2 ступень NaНSО3+ НОН ↔ Н2SО3+ NaOH
НSО3-+ НОН ↔ Н2SО3+ ОН-
2. Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (ZnCl2, Cu(NO3)2 и др.).
Среда при гидролизе кислая (рН<7). Например:(для многоосновных - ступенчато).
1 Ступень Cu(NO3)2+ НОН ↔ CuОНNO3+ НNO3
Cu2++ НОН ↔CuОН++ Н+
2 Ступень CuОНNO3+ НОН ↔Cu(ОН)2+НNO3
CuОН++НОН↔ Cu(ОН)2+Н+ (хотя в данном случае 2-ой ступенью принебрегают).
3. Гидролиз по катиону и аниону – гидролиз солей образованных катионом слабого основания и анеоном слабой кислоты. (CuF2, Al2S3 и т.д.)
CuF2+НОН↔CuОНF+НF
Cu2++НОН↔CuОН++Н+
CuОНF+ НОН ↔ Cu(ОН)2+ НF
CuОН++ НОН ↔ Cu(ОН)2+ Н+
В данном случае гидролиз протекает довольно интенсивно. Образующиеся при гидролизе ОН- и Н+ связываются в молекулу НОН, что усиливает гидролиз и по катиону и по аниону. Реакция среды зависит от соотношения констант диссоциации образующихся кислоты и основания. В данном случае КНF >КCuОН+, рН <7.
Если кислота и основание не только слабые электролиты, но и малорастворимые или неустойчивые вещества, то гидролиз в ряде случаев идет до конца и протекает практически необратимо:
Al2S3+6H2O→2Al(OH)3↓+3H2S↑ (Необратимо гидролизующиеся соли невозможно получить в результате реакции обмена в водном растворе).
Количественные характеристики гидролиза: это степень гидролиза (h) и константа гидролиза (Kг).
h=Сг/Со, где Сг – концентрация гидролизованой части соли, Со – общая концентрация соли в растворе.
В общем виде гидролиз по аниону: An-+ НОН↔HAn+ ОН- Kг=CHAn∙CОН-/Cсоли
Гидролиз по катиону: Kat++ НОН↔ KatОН+ Н+, Kг=CKatOH∙CН+/Cсоли
Для гидролиза и по катиону и по аниону Kг= CKatOH∙CHAn / CН+∙ CОН-
Каждая ступень многозарядных ионов – имеет свою константу гидролиза.
Kг=с∙h2 или же h=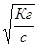
Литература:
1. Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
2. Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
- Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
- Кузьменко Н.Е. Краткий курс химии / Н.Е. Кузьменко, В.В Еремин, В.А. Попков. – М.: Высшая школа, 2002. – 415 с.
|
|
Дата добавления: 2014-01-05; Просмотров: 2049; Нарушение авторских прав?; Мы поможем в написании вашей работы!