
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворение в результате окислительно-восстановительных реакций
|
|
|
|
Растворение осадков вследствие комплексообразования
Процессы комплексообразования вызывают уменьшение равновесной концентрации ионов в насыщенном растворе малорастворимого соединения. Это смещает равновесие в системе раствор—осадок и вызывает, таким образом, растворение осадка. Например, при введении NH3 в насыщенный раствор AgCI происходит образование аммиачных комплексов серебра. Концентрация ионов серебра уменьшается, что вызывает сдвиг равновесия и растворяется дополнительное количество хлористого серебра.
Применение окислительно-восстановительных реакций нередко является единственным путем растворения малорастворимого соединения. Типичным примером является растворение многих сульфидов. Например, сульфид меди CuS даже в концентрированной соляной кислоте практически нерастворим (растворимость составляет величину порядка 10-7 моль/л). Однако уже в разбавленной азотной кислоте сульфид меди легко растворяется:
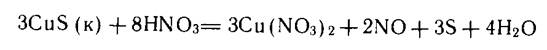
Другим примером является МпО2. В азотной кислоте это соединение нерастворимо, а в соляной растворяется легко:
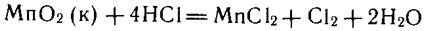
что связано с восстановительными свойствами НС1.
На практике обычно применяют комбинированные способы растворения. Часто эти способы взаимосвязаны. Например, азотная кислота действует как сильная кислота и как сильный окислитель. В неорганическом анализе часто используется смесь концентрированных кислот: соляной и азотной — так называемая царская водка. Смесь этих кислот действует как сильная кислота и как сильный окислитель, и обладает, кроме того, комплексообразующими свойствами (НС1 образует устойчивые комплексные соединения с ионом ртути (II) и некоторыми другими катионами).
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1239; Нарушение авторских прав?; Мы поможем в написании вашей работы!