
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон збереження маси
|
|
|
|
 Один з основних законів хімії — закон збереження маси — відкритий і експериментально підтверджений великим російським вченим М. В. Ломоносовим у 1748 р. Цей закон можна сформулювати так: маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися внаслідок реакції. В 1789 р. закон збереження маси незалежно від М. В. Ломоносова відкрив французький хімік А. Л. Лавуазьє, який довів, що під час реакції залишається сталою не тільки загальна маса речовини, а й маса кожного з елементів речовин, що взаємодіють.
Один з основних законів хімії — закон збереження маси — відкритий і експериментально підтверджений великим російським вченим М. В. Ломоносовим у 1748 р. Цей закон можна сформулювати так: маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися внаслідок реакції. В 1789 р. закон збереження маси незалежно від М. В. Ломоносова відкрив французький хімік А. Л. Лавуазьє, який довів, що під час реакції залишається сталою не тільки загальна маса речовини, а й маса кожного з елементів речовин, що взаємодіють.
Закон збереження маси став науковою основою для створення перших понять хімії, для відкриття нових законів. Завдяки цьому закону М. В. Ломоносов і А. Л. Лавуазьє дали перші уявлення про хімічні елементи та різні види речовин.
Видатний російський фізик П. М. Лебедєв експериментально довів, що світло здатне чинити тиск, його можна розглядати як один із видів матерії. Подібні досліди наштовхнули великого німецького фізика А. Ейнштейна на думку, що між масою тіла т і його енергією Е існує зв'язок:
Е = тс2,
де с — швидкість світла.
Отже, рівняння Ейнштейна є математичним виразом закону збереження маси й енергії — одного з основних законів сучасної фізики, який іноді називають законом еквівалентності маси й енергії. Згідно з цим законом, зміні маси на величину т відповідає цілком певна зміна енергії.
Невеликі зміни маси повинні викликати значні енергетичні ефекти, оскільки множник с2 дорівнює 9 * 1016 (швидкість світла становить 3 * 108 м/с). Невеликі енергетичні ефекти, що супроводжують хімічні реакції, не можуть привести до помітних змін мас речовин, тому під час перевірки закону збереження маси на хімічних реакціях завжди підтверджувалась його справедливість.
|
|
|
6. ЗАКОН СТАЛОСТІ СКЛАДУ
Завдяки відкриттю закону збереження маси в кінці XVIII ст. в хімії міцно укорінились кількісні методи дослідження, було вивчено кількісний склад багатьох речовин, відомий французький хімік Ж. Пруст відкрив закон сталості складу, який формулюється так: кожна індивідуальна молекулярна сполука має сталий якісний і кількісний склад незалежно від способу її добування.
З відкриттям цього закону хімічною сполукою почали називати будь-яку індивідуальну складну речовину, що має сталий склад. Проте із закону сталості складу не можна зробити висновок, що одному й тому самому кількісному складу відповідає одна сполука. Закон сталості складу не є загальним, він має істотні обмеження. Наприклад, для сполук, що мають молекулярну будову, цей закон справджується цілком, а для сполук з іншою будовою відомо багато сполук, що мають не сталий, а змінний склад. Так, вивчаючи сплави металів, видатний російський вчений М. С. Курнаков на початку XX ст. виявив сполуки змінного складу; в 30-х роках XX ст. виявлено такі самі сполуки серед оксидів, сполук металів з Сульфуром (сульфідів), Нітрогеном (нітридів), Карбоном (карбідів), Гідрогеном (гідридів).
 Після відкриття ізотопів з'ясувалось, що із зміною ізотопного складу елемента змінюється і масовий склад сполуки. Так, важка вода містить близько 20 % Гідрогену, а звичайна — лише 11 %. Отже, співвідношення між масами елементів, що входять до складу певної речовини, сталі лише за умови сталості ізотопного складу цих елементів.
Після відкриття ізотопів з'ясувалось, що із зміною ізотопного складу елемента змінюється і масовий склад сполуки. Так, важка вода містить близько 20 % Гідрогену, а звичайна — лише 11 %. Отже, співвідношення між масами елементів, що входять до складу певної речовини, сталі лише за умови сталості ізотопного складу цих елементів.
7. ЗАКОН КРАТНИХ ВІДНОШЕНЬ
Видатний англійський хімік і фізик Дж. Дальтон, вивчаючи сполуки, утворені одними й тими самими елементами, відкрив у 1803 р. закон кратних відношень: якщо два елементи утворюють один з одним кілька сполук молекулярної будови, то на одну й ту саму кількість одного з них припадають такі кількості іншого, які відносяться між собою як невеликі цілі числа.
|
|
|
Цей закон стає зрозумілішим, якщо його проілюструвати на прикладі оксигеновмісних сполук Нітрогену (табл. 1). Як видно з таблиці, масові частки Оксигену, що припадають на одну масову частку Нітрогену, відносяться між собою як числа 0,57: 1,14: 1,71: 2,29: 2,85, тобто як невеликі цілі числа 1:2:3:4:5.
Таблиця 1. Склад оксидів нітрогену
| Оксид нітрогену | Склад, % | Склад, мас. ч. | ||||
| Нітроген | Оксиген | Нітроген | Оксиген | |||
| N20 | 63,7 | 36,3 | 0,57 | |||
| N0 | 46,7 | 53,3 | 1,14 | |||
| N03 | 36,9 | 63,1 | 1,71 | |||
| N02 | 30,5 | 69,5 | 2,29 | |||
| N205 | 25.9 | 74,1 | 2,85 | |||
Отже, закон кратних відношень показує, що якщо одні й ті самі елементи створюють один з одним кілька сполук, то кількісні співвідношення елементів від сполуки до сполуки змінюються стрибкоподібно, а їхні властивості відрізняються. Це добре підтверджується законом діалектики про перехід кількісних змін у якісні.
Проте закон кратних відношень, як і закон сталості складу, не є загальним також має свої обмеження. Для сполук з немолекулярною структурою масові кількості одного елемента, що припадають на одну й ту саму кількість іншого, можуть відноситись як дробові числа. Наприклад, Титан може утворювати сполуку, в якій число атомів Гідрогену коливається від 1 до 2 атомів на 1 атом Титану; формула цієї сполуки записується у вигляді ТіНі_2.
Змінність складу характерна для сполук Танталу з Селеном ТаSe 1,75 -2,5, Титану з Карбоном ТіС0,6_1. Такі формули відображують не склад молекули, а лише межі складу молекули речовини. Зрозуміло, що в цьому разі закон кратних відношень буде неприйнятний.
 Отже, поряд із сполуками із сталим (дискретним) складом, що на честь вченого Дж. Дальтона, який відкрив закон перервності складу, називаються дальтонідами, існують сполуки із змінним (безперервним) складом — бертоліди, які досліджував французький хімік К. Л. Бертолле.
Отже, поряд із сполуками із сталим (дискретним) складом, що на честь вченого Дж. Дальтона, який відкрив закон перервності складу, називаються дальтонідами, існують сполуки із змінним (безперервним) складом — бертоліди, які досліджував французький хімік К. Л. Бертолле.
Закон кратних відношень відображує перервність молекулярного складу сполук. Завдяки відкриттю цього закону виявлено дискретну будову речовин.
8. ЗАКОН ЕКВІВАЛЕНТІВ
 Закон сталості складу сприяв тому, що в хімію згодом були введені поняття еквівалент і молярна маса еквівалента («еквівалентний» означає «рівноцінний»).
Закон сталості складу сприяв тому, що в хімію згодом були введені поняття еквівалент і молярна маса еквівалента («еквівалентний» означає «рівноцінний»).
|
|
|
Еквівалентом елемента називають таку його кількість, яка сполучається з одним молем атомів Гідрогену або заміщує таку саму кількість атомів Гідрогену в хімічних реакціях.
 Маса одного еквівалента елемента називається молярною масою еквівалента. Наприклад, у сполуках НF, Н20, NНз еквіваленти Флуору, Оксигену та Нітрогену дорівнюють 1; 1/2; 1/3 моль, а молярні маси еквівалентів відповідно 18,99; 8; 4,67 г/моль.
Маса одного еквівалента елемента називається молярною масою еквівалента. Наприклад, у сполуках НF, Н20, NНз еквіваленти Флуору, Оксигену та Нітрогену дорівнюють 1; 1/2; 1/3 моль, а молярні маси еквівалентів відповідно 18,99; 8; 4,67 г/моль.
Поняття про еквівалент і молярну масу еквівалента поширюються і на складні речовини.
Еквівалентом складної речовини називається така її кількість, яка взаємодіє без залишку з одним еквівалентом водню або з одним еквівалентом будь-якої іншої речовини.
Зрозуміло, що в хімічних реакціях різні індивідуальні речовини беруть участь у суворо еквівалентних кількостях. В цьому і полягає закон еквівалентів: хімічні елементи сполучаються один з одним, а речовини реагують між собою у кількостях, пропорційних їхнім еквівалентам.



 Валентність елемента в найзагальнішому означенні — це здатність атомів цього елемента сполучатися з певним числом атомів інших елементів, тобто у певному співвідношенні, або утворювати певне число хімічних зв'язків між: атомами. За наближеним значенням молярної маси атомів та точною молярною масою еквівалента елемента обчислюють його валентність, пам'ятаючи, що вона може бути тільки цілочисельною. Помноживши знайдену величину молярної маси еквівалента на валентність елемента, дістають точне значення молярної маси елемента, яке чисельно дорівнює його атомній масі.
Валентність елемента в найзагальнішому означенні — це здатність атомів цього елемента сполучатися з певним числом атомів інших елементів, тобто у певному співвідношенні, або утворювати певне число хімічних зв'язків між: атомами. За наближеним значенням молярної маси атомів та точною молярною масою еквівалента елемента обчислюють його валентність, пам'ятаючи, що вона може бути тільки цілочисельною. Помноживши знайдену величину молярної маси еквівалента на валентність елемента, дістають точне значення молярної маси елемента, яке чисельно дорівнює його атомній масі.
Запитання для самоконтролю
1. Що таке кількість речовини? В яких одиницях виражають цю величину?
2. Поясніть, чим хімічний елемент відрізняється від простої речовини.
3.Які методи визначення молекулярних та атомних мас ви знаєте?
4. Дайте визначення понять: «еквівалент», «молярна маса еквівалента». В якому спів відношенні перебувають молярна маса, молярна маса еквівалента та валентність певного елемента?
|
|
|
4. Які розрахунки можна виконати, знаючи формулу хімічної сполуки?
| Поняття | позначення | формула | Одиниці вимірювання |
| маса атомна маса відносна атомна маса молекулярна маса | m А Аr М | 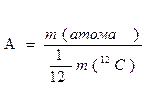
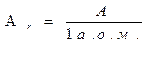
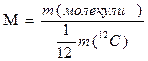
| кг; г а.о.м. безрозмірна величина а.о.м. |
| Відносна молекулярна маса | Мr | 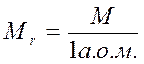
| безрозмірна величина |
Основні розрахункові формули
Корисні співвідношення між одиницями фізичних величин:
1а.о.м.=1,661*10-27кг=1,661*10-24г
| Газові закони | Розрахункові формули | |||
          Закон Бойля-Маріотта
Закон Гей – Люссака
Закон Авогадро
Закон Шарля Закон Бойля-Маріотта
Закон Гей – Люссака
Закон Авогадро
Закон Шарля
Об'єднаний газовий закон
Рівняння Менделєєва – Клапейрона
Рівняння стану ідеального газу | V1 = P2 (при постійних T і n) V2 P1 V1 = T1 (при постійних P і n) V2 T2 V1 = n1 (при постійних P і T) V2 n2 P1 = T1 (при постійних V і n) P2 T2 P1 V1 = P2 V2 T1 T2 m PV= M RT PV= n RT | |||
| Позначення: V-об’єм; P-тиск; T-температура; n-кількість речовини; m-маса речовини; M- молярна маса речовини; R-універсальна газова стала, R=8,314 Дж/(К · моль) = 0,08205 л·атм/(K · моль). Нормальні умови: 0º С и 1,013 · 105 Па. Нормальний тиск:1,013 · 105 Па =1 атм = 760 мм рт.ст. Корисні співвідношення між одиницями фізичних величин: 1 дм3 =1л = 1000мол = 10-3 м3; 1 Па =1 Н/м2 = 1 Дж/м3; 1моль/м3 =10-3моль/л; RT=2, 4789 кДж/моль (при 298 К). |
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2356; Нарушение авторских прав?; Мы поможем в написании вашей работы!