
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Донорно-акцепторний механізм утворення ковалентного зв’язку
|
|
|
|
КОВАЛЕНТНИЙ ЗВ'ЯЗОК. МЕТОД ВАЛЕНТНИХ ЗВ’ЯЗКІВ
Типовий ковалентний зв'язок виникає між атомами одного елемента, наприклад, у молекулах водню, кисню, азоту, хлору тощо. Спільна пара електронів, за допомогою якої здійснюється ковалентний зв 'язок, розміщується у просторі симетрично відносно ядер обох атомів. Такий ковалентний зв'язок називається неполярний, або гомеополярним. Неполярний ковалентний зв'язок може утворитися не тільки між однаковими атомами, а й між атомами з близькими електронегативностями. Якщо ж електронегативності атомів, що сполучаються між собою, відрізняються, то спільна пара електронів зміщується в бік одного з цих атомів. У цьому разі порушується симетрія розподілу електричного заряду. З одного кінця такого зв'язку буде надлишок позитивного заряду, а з другого — негативного.
Полярний, або гетерополярний, зв 'язок — це такий ковалентний зв 'язок, що характеризується зміщенням спільної пари електронів у бік одного із сполучених цим
зв 'язком атомів.
Зміщення спільної пари електронів у разі утворення полярного ковалентного зв'язку призводить до того, що середня густина негативного електричного заряду буде вищою поблизу більш електронегативного атома і нижчою— поблизу менш електронегативного. Отже, один атом набуде надлишкового негативного, а другий — надлишкового позитивного заряду. Ці заряди називаються ефективними (реальними) зарядами атомів у молекулі.
Крім розглянутого механізму спарювання електронів існує й інший механізм утворення ковалентного зв'язку. Метод валентних зв'язків стверджує, що ковалентний зв'язок має бути двох електронним, двоцентровим і локалізованим у просторі незалежно від того, як виникає спільна електронна пара. Проте спільна електрона пара може утворитись не тільки за рахунок спарювання електронів, що належали орбіталям окремих атомів, а й внаслідок взаємодії неподіленої електронної пари одного атома та вільної орбіталі іншого: А'. + DB -» А:В. Такий механізм називають донорно-акцепторним. Роль донора в разі утворення цього зв'язку може відігравати будь-яка частинка, що має неподілені електронні пари, порівняно великі розміри та надлишковий негативний заряд на поверхні. Зазначеним вимогам відповідають насамперед негативно заряджені іони (аніони) та нейтральні молекули, утворені елементами з великою електронегативністю, передусім киснем і азотом, а також численні їхні похідні — спирти, кислоти, ефіри, аміни тощо. До них належать також сполуки, які містять атоми неметалів з малою електронегативністю (сірка, фосфор, селен тощо), оскільки вони слабко утримують неподілені електронні пари. Навпаки, роль акцепторів зазвичай відіграють малі за розміром частинки, які мають вільні електронні орбіталі на валентних підрівнях, деякий позитивний заряд на поверхні. Найчастіше це — катіони металів або нейтральні атоми. Найпростішим прикладом утворення ковалентного зв'язку за донорно-акцепторним механізмом є взаємодія молекули аміаку або молекули води з катіоном водню:
|
|
|
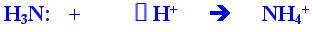

Чотири зв'язки N—Н в утвореному іоні амонію NH4+ так само, як і три зв'язки Н—О в іоні гідроксонію НзО+, стали цілком рівноцінними між собою незалежно від початкового механізму їх виникнення, тобто ковалентний зв'язок, що утворюється за механізмом спарювання електронів, нічим не відрізняється від зв'язку, утвореного за донорно-акцепторним механізмом. Зауважимо, що внаслідок приєднання іона водню до молекули аміаку атом азоту насичує свою валентність і стає чотириковалентним. При цьому він використовує всі свої валентні орбіталі другого енергетичного рівня. Більшого числа ковалентних зв'язків атом азоту утворити не може.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 5019; Нарушение авторских прав?; Мы поможем в написании вашей работы!