
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод кислотно – основного титрування
|
|
|
|
Лекція №10
Зміст
1. Теоретичні основи методу.
2. Індикатори методу кислотно-основного титрування.
3. Інтервал переходу індикатора.
4. Показник титрування індикатора.
Контрольні питання
Література
Питання до самостійного вивчення
Викладач Ю.В. Старушенко
1. Теоретичні основи методу.
У кислотно-основному титруванні як робочі розчини використовують розчини сильних кислот (HCl, H2SO4) або сильних основ (NaOH, KOH, Ba(OH)2) концентрації від 0,05 до 1 моль/л. Розчини кислот стійкі і можуть довго зберігатися. Розчини лугів зберігають у парафінованому або фторопластовому посуді, щоб не допустити взаємодії зі склом. Розчини лугів поглинають CO2 з повітря.
Приготувати розчин точної концентрації кислоти або лугу із продажних реактивів не можна. Точну концентрацію розчинів установлюють по одному з первинних стандартів.
До первинних стандартів висувають жорсткі вимоги:
1) речовина повинна бути хімічно чистою;
2) склад речовини повинен строго відповідати хімічній формулі (наприклад, повинна бути певна кількість кристалізаційної води H2C2O4·2H2O);
3) речовина повинна бути стійкою при зберіганні;
4) бажано можливо більша величина молярної маси еквівалента.
Розрізняють ацидиметричне титрування, у якому в якості титранту використовують розчини сірчаної або соляної кислот, і алкалиметричне титрування, де титрантом є розчини гідроксиду натрію або калію.
Відповідно до сили кислот і основ можливі такі типи кислотно – основної взаємодії:
1. між сильною кислотою і сильною основою;
2. між сильною кислотою і слабкою основою;
3. між слабкою кислотою і сильною основою;
4. між слабкою кислотою і слабкою основою.
Внаслідок взаємодії кислоти і основи утворюються сіль і вода. У першому випадку утворюється сіль сильної кислоти і сильної основи. Такі солі у водних розчинах не зазнають гідролізу, і в точці еквівалентності, коли кислота цілком нейтралізована лугом, реакція буде нейтральна, тобто рН дорівнюватиме 7. Як приклад титрування сильної кислоти сильною основою можна навести взаємодію між гідроксидом натрію і соляною кислотою. Внаслідок реакції утворюється хлорид натрію, розчин якого має нейтральну реакцію:
|
|
|
NaОН + НС1 = Н2O + NaС1.
У другому випадку в точці еквівалентності утвориться сіль сильної кислоти і слабкої основи. Прикладом такого титрування є взаємодія між гідроксидом амонію і соляною кислотою:
NН4ОН + НСl = Н2O + NH4С1.
Солі слабких основ і сильних кислот у водних розчинах гідролізують:
NН4С1 + НОН ↔ NН4ОН + НС1,
або в іонному вигляді
NH4+ + Cl- + HOH ↔ NН4ОН + H+ + Cl-
Скоротивши спільні іони, матимемо:
NH4+ +НОН ↔ NН4ОН + Н+
Звідси видно, що в результаті реакції гідролізу в розчині збільшується концентрація водневих іонів. Таким чином, у точці еквівалентності при титруванні слабкої основи сильною кислотою реакція буде кислою, рН < 7.
У третьому випадку при титруванні сильної основи слабкою кислотою утворюється сіль сильної основи і слабкої кислоти. Наприклад:
NaОН + СН3СООН ↔ Н2О + СН3СООNa
Солі слабких кислот і сильних основ у водних розчинах також зазнають гідролізу:
СН3СООNa + НОН ↔ СН3СООН + NaОН,
або в іонному вигляді
Na+ + СН3СОО- + НОН ↔ СН3СООН + Na+ + ОН-.
Cкоротивши спільні іони, матимемо:
СН3СОО- + НОН ↔СН3СООН + ОН-.
Таким чином, у точці еквівалентності збільшиться концентрація гідроксильних іонів, реакція розчину буде лужна, pH > 7.
У четвертому випадку при взаємодії слабкої кислоти із слабкою основою у точці еквівалентності утворюється сіль слабкої кислоти і слабкої основи, Наприклад:
СН3СООН + NH4OH ↔ СН3СООNH4 + Н2О.
Солі такого типу у водних розчинах піддаються гідролізу значною мірою:
|
|
|
CH3COONH4 + НОН ↔ СН3СООН + NH4OH,
СН3СОО- + NH4+ + НОН ↔ СН3СООН + NH4OH.
У цьому випадку реакція розчину залежить від сили кислоти і основи; якщо кислота і основа однакової сили (константи дисоціації їх рівні), то розчин матиме нейтральну реакцію: pH = 7. Якщо ж сильнішою буде кислота, то реакція розчину буде слабкокислою, а при більшій силі основи порівняно з кислотою — слабколужною.
Для титрування слабкої кислоти слабкою основою не можна підібрати відповідного індикатору. Тому слабку кислоту титрувати слабкою основою не можна. Не можна, звичайно, також титрувати слабку основу слабкою кислотою.
2. Індикатори методу кислотно-основного титрування.
При титруванні до розчину одного компонента добавляють розчин другого компонента, поки буде досягнута точка еквівалентності, тобто поки кількості добавленого і взятого компонентів будуть еквівалентними. У методі нейтралізації розчин кислоти титрують розчином основи або навпаки. Для визначення кінця титрування використовують індикатори. Практично майже неможливо підібрати індикатор, який показав би кінець титрування в кінці еквівалентності. Тому точку кінця титрування, яку визначають індикатором, називають кінцевою точкою титрування. Кінцева точка титрування завжди відрізняється від точки еквівалентності. Чим більше ці точки різняться між собою, тим більша помилка титрування.
Індикатори – речовини, які змінюють свою будову і фізичні властивості при зміні властивостей середовища. Індикатори кислотно-основного титрування змінюють будову і властивості при зміні рН середовища.
Ідикатори методу нейтралізації є слабкими органічними кислотами або основами, молекулярна форма яких має інше забарвлення, ніж іонна. Індикатори методу нейтралізації бувають одно- і двоколірні. Одноколірні індикатори мають забарвлення лише в одній, звичайно іонній (сольовій) формі. Колір цих форм різний і залежить від pH розчину.
У водних розчинах кислотні індикатори дисоціюють на іони:
 (1)
(1)
Характеристикою індикатора є його константа кислотної дисоціації:
 (2)
(2)
Залежно від величини константи дисоціації кислотно-основні індикатори поділяють на сильні, проміжні і слабкі. Сильні індикатори характеризуються величиною  >10-7 і змінюють своє забарвлення в кислому середовищі при рН<7. Типовим представником цієї групи індикаторів є метилоранж, забарвлення якого змінюється в межах рН = 3,4—4,3.
>10-7 і змінюють своє забарвлення в кислому середовищі при рН<7. Типовим представником цієї групи індикаторів є метилоранж, забарвлення якого змінюється в межах рН = 3,4—4,3.
|
|
|
Метилоранж є амфотерним електролітом, який і в нейтральних, і в лужних розчинах перебуває в іонному стані. Зміна структури метилоранжу при переході з лужних і нейтральних розчинів у кислі характеризується таким рівнянням:

рожевий жовтий
Індикатори проміжної сили змінюють своє забарвлення при рН ≈ 7. До цієї групи індикаторів належить лакмус, який змінює своє забарвлення в межах рН = 6,8—7,2.
Слабкі індикатори змінюють забарвлення в слабколужному середовищі. Типовим представником цієї групи індикаторів є фенолфталеїн, дві гідроксильні групи якого мають кислотний характер.
При переході в сольову форму змінюється структура фенолфталеїну:

безбарвний червоний
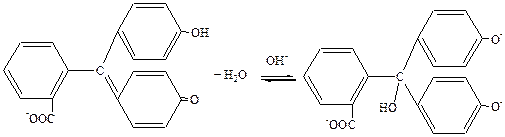
червоний карбінольна основа –
знову безбарвна в сильно
лужному середовищі
при великій концентрації лугу (рН = 13,5 – 14) фенолфталеїн переходить в іншу, безбарвну форму.
3. Інтервал переходу індикатора.
Колір індикатора залежить від концентрації водневих іонів розчину. Розглянемо характер цієї залежності для кислотних індикаторів. Установлені залежності справджуються також для індикаторів інших типів.
З рівняння (1) видно, що стан рівноваги між молекулярною та іонною формами індикатора залежить від величини рН розчину. З константи дисоціації індикатора можна обчислити межі рН, в яких змінюватиметься його забарвлення в розчині. При цьому треба мати на увазі, що людське око помічає зміну забарвлення розчину лише в тому випадку, коли не менш як 10% загальної кількості індикатора переходить з однієї забарвленої форми в іншу.
Цей інтервал рН називають інтервалом переходу індикатора. Для переважної більшості індикаторів інтервал переходу за рівнянням лежить у межах двох одиниць рН.
Проте треба зазначити, що величина інтервалу переходу до деякої міри залежить також від індивідуальних особливостей індикаторів, зокрема від кольору та інтенсивності забарвлення молекулярної і сольової форм індикатора.
|
|
|
Інтервал переходу кислотно-основних індикаторів, залежно від величини рН, наведено в табл. 1.

|
4. Показник титрування індикатора.
У межах інтервалу переходу індикатора є значення рН, при якому спостерігається найбільш помітна людським оком зміна кольору індикатора. Це значення рН називають показником титрування індикатора і позначають рТ.
Різка зміна кольору відбувається, як правило, в той момент, коли концентрації іонної і молекулярної форм індикатора стають однаковими; тому показник титрування здебільшого збігається з величиною логарифма константи дисоціації з оберненим знаком —рК.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 4880; Нарушение авторских прав?; Мы поможем в написании вашей работы!