
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод осадження
|
|
|
|
Лекція №12
Зміст
1. Загальна характеристика методу.
2. Метод Мора.
3. Метод Фаянса.
4. Метод Фольгарда.
Контрольні питання
Література
Питання до самостійного вивчення
Викладач Ю.В. Старушенко
1. Загальна характеристика метода.
Методи осаджувального титрування об’єднують ті методи титриметричного визначення при яких у результаті реакції проходить кількісне осадження визначаємої речовини.
Основну реакцію методу осадження в загальному вигляді можна виразити рівнянням:
mKt+ + n An- = KtmAnn↓
Реакції осадження є надзвичайно поширеними в аналітичній хімії. Однак широкому використанню їх у титриметрії заважають такі проблеми:
а) У момент еквівалентності між визначаємою речовиною і доданим титрованим розчином часто не буває досить повного осадження визначаємого йону
б)В результаті реакцій осадження часто утворюються аморфні осади. Останні
адсорбують на своїй поверхні визначаємі та сторонні йони, що заважає точному встановленню точки кінця титрування.
в) Осад заважає спостереженню зміни забарвлення індикатора
г) У зв’язку з різноманітністю складу осадів не існує індикаторів, загальних для методу осадження. Частіше всього в кожному окремому методі користуються спеціальним індикатором.
Основною вимогою, що ставиться до реакції, яка застосовується в методах осадження, є мінімальна розчинність утвореного осаду.
Класифікація методів осаджувального титрування.
1. Аргентометрія – метод титриметрії, оснований на застосуванні стандартного розчину AgNO3. Використовується, зазвичай, для визначення галогенід – іонів:
Ag+ + НаІ- = Ag НаІ↓
2. Меркурометрія - метод титриметрії, оснований на утворенні малорозчинних сполук одновалентного меркурію:
|
|
|
Нg22+ + + 2 СІ - = Нg2СІ2↓
Як індикатор у меркурометрії використовують:
а) розчин ферум тіоціонату (характерного «криваво – червонного» забарвлення), який знебарвлюється в присутності надлишку Нg22+- йонів:
3Нg22+ + 2 Fe(CNS)3 = 2 Fe3+ + 3Hg2(CNS)2
б) дифенілкарбозон, який утворює з Нg22+ комплексну сполуку синього кольору (власне забарвлення індикатора червоне).
3. Сульфатометрія – метод осаджувального титрування, оснований на застосуванні стандартного розчину Na2SO4. Точку кінця титрування встановлюють за допомогою металохромних індикаторів.
Реакції, які застосовуються в методах осадження повинні задовольняти наступним умовам:
1. Осад повинен випадати швидко та бути практично нерозчинним.
2. На результати титрування не повинні впливати побічні реакції.
3. Точка еквівалентності повинна легко фіксуватися.
Точку еквівалентності в методах осадження визначають:
Або за допомогою індикатора, або за зміною фізико – хімічних властивостей розчину – електропровідності, поглинання або відображення світла.
Метод аргентометрії застосовують:
Для аналізу солей галогеноводневих кислот – хлоридів, бромідів, йодидів лужних та лужно – земельних металів та органічних основ.
Методи осадження широко застосовуються в аналізі фармацевтичних препаратів.
В залежності від того, яким чином фіксується точка еквівалентності, в аргентометрії розрізняють методи :
1) метод Гей – Люссака - який дозволяє встановити точку кінця титрування, реакція проходить між Ag+ і НаІ- без індикатора.
Для цього до розчину, що містить СІ- - йони, доливають із бюретки малими порціями стандартний розчин нітрату аргентуму. При цьому розчин стає мутним. Кожну наступну порцію розчину нітрату аргентуму вводять лише після того, як розчин над осадом злегка просвітліє. Доливання з бюретки стандартного розчину закінчують у той момент, коли наступна крапля долитого розчину нітрату аргентуму не викличе утворення нових кількостей осаду хлориду аргентуму. У точці еквівалентності розчин над осадом стає прозорим внаслідок коагуляції хлориду аргентуму.
|
|
|
2) Метод Мора - оснований на реакції, яка проходить між Ag+ і СІ- - йонами в присутності розчину K2CrO4 як індикатора.
3) Метод Фольгарда - оснований на реакції, яка протікає між Ag+ і SCN- йонами в присутності індикатора – йонів Fe3+.
4) Метод Фаянса – базується на великій адсорбційній здатності аморфних осадів.
2. Метод Мору.
Метод Мора оснований на реакції осадження СІ- і Вr- - йонів йонами аргентуму з утворенням важкорозчинних галогенідів:
СІ- + Ag+ = AgСІ↓
Вr- + Ag+ = Ag Вr↓
Робочим розчином в методі є AgNO3.
Кінець титрування встановлюють за допомогою індикатора K2CrO4.
За методом Мора визначають:
Хлориди і броміди - за допомогою титрування розчином AgNO3.
Солі аргентуму - за допомогою титрування розчином NaСІ або КСІ.
Визначення йодидів і роданідів цим методом не проводять, тому що осади, що утворюються – AgІ та AgSCN, адсорбують K2CrO4, і стає неможливим фіксування точки еквівалентності.
Застосування K2CrO4 в якості індикатора ґрунтується на тому, що йон CrO42- з Ag+ утворює осад цегляно – червоного кольору Ag2CrO4:
2 Ag+ + CrO42- = Ag2CrO4↓
Титрування по методу Мора проводиться в нейтральному або слабко лужному середовищі при рН від 7,0 до 10,0. В кислих розчинах титрування проводити неможливо, тому що осад Ag2CrO4 розчиняється в сильно – лужному середовищі йони Ag+ з йонами ОН- утворюють AgОН. Котрий розпадається:
2 AgОН = Ag2О + Н2О
Метод Мора неможливо застосовувати в аміачному середовищі, тому що осади AgСІ та Ag2CrO4 розчиняються з утворенням комплексного йону [Ag(NН3)2]+:
AgСІ + 2 NН4ОН = [Ag(NН3)2]СІ + 2 Н2О
Ag2CrO4 + 2 NН4ОН = [Ag(NН3)2] CrO4 +2 Н2О
Метод не можна застосовувати в присутності йонів Ва2+, Рb2+, Ві3+, які утворюють осади з K2CrO4,а також в присутності забарвлених розчинів.
Титрування по методу Мора проводять в певній послідовності: завжди до відміреного об’єму солі галогену додають розчин солі аргентуму, тобто титрування ведуть від галогену до нітрату аргентуму. Тільки в цьому випадку утворюється різка зміна забарвлення індикатора. При кінці титрування розчин нітрату аргентуму додають повільно. По краплям, для того, щоб осад уплотнився.
|
|
|
Таблиця 1. Аргентометричне титрування по методу Мору.

3. Метод Фаянса.
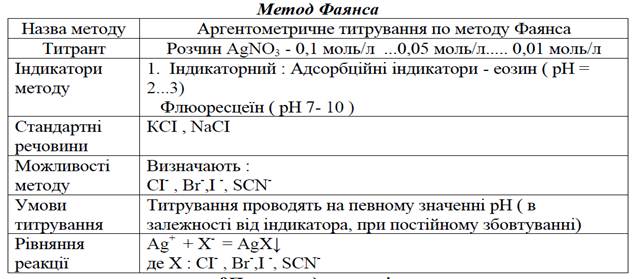
Метод Фаянса базується на прямому титруванні галогенідів стандартним розчином AgNO3 в присутності адсорбційних індикаторів.
Осади, які утворюються в результаті тієї чи іншої реакції, як правило адсорбують на своїй поверхні різні йони з розчину. Адсорбційна здатність осадів вибіркова. Адсорбції піддаються переважно ті йони, з яких складається сам осад. Якщо до розчину KBr додавати розчин AgNO3, то осад AgBr буде адсорбувати на своїй поверхні переважно Br - (або Ag+ у випадку його надлишку). Інтенсивність адсорбції пропорційна концентрації.
При осадженні йонів Br – поступовим додаванням AgNO3 до того моменту, коли наступає точка еквівалентності концентрація Br – в розчині значно перевищує концентрацію Ag+, тому AgBr буде адсорбувати переважно негативно заряджені йони Br – та внаслідок цього всі частинки осаду AgBr будуть заряджені негативно. Якщо додати надлишок AgNO3, концентрація йонів аргентуму буде значно більшою, ніж йонів брому, тому осад AgBr буде адсорбувати Ag+ і частинки осаду будуть заряджені позитивно. Тобто, в процесі титрування в точці еквівалентності заряд осаду змінюється на протилежний.
На цих властивостях осаду базується застосування адсорбційних індикаторів
Вперше застосування таких індикаторів запропонував Фаянс.
Суть методу Фаянсу:
Якщо під час титрування в розчині знаходиться барвник, у якого забарвленим є аніон, то до кінця титрування забарвлені йони барвника будуть відштовхуватись від осаду та осад буде не забарвленим. Коли титрування закінчується і відбувається перезарядження поверхні осаду, забарвлені аніони барвника почнуть притягуватись до поверхні осаду і він забарвлюється.
Фаянс запропонував в якості адсорбційних індикаторів: Флюоресцеїн, дихлорфлюоресцеїн, еозин.
Малюнок 1.Механізм дії адсорбційних індикаторів.
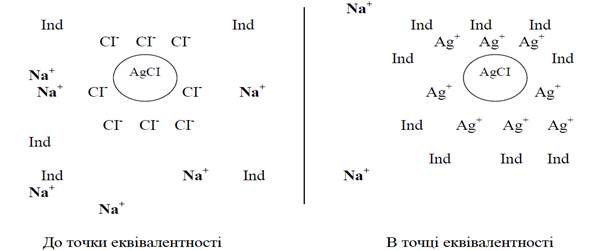
Всі ці барвники є слабкими органічними кислотами.
Зміна забарвлення адсорбційних індикаторів в точці еквівалентності:
|
|
|
Флюоресцеїн - рожевий колір;
Дихлорфлюоресцеїн - темно – червоний;
Еозин - червоно – фіолетовий.
Умови титрування адсорбційними індикаторами:
1. Флюоресцеїн, дихлорфлюоресцеїн застосовуються при визначенні хлоридів, бромідів, йодидів, роданідів
Еозин - тільки при титруванні бромідів, йодидів, роданідів
2. При застосуванні флюоресцеїну рН розчину 7,0 – 10,0;
Дихлорфлюоресцеїн рН розчину до 4,0;
Еозину – рН розчину до 3,0
3. Титрування проводять при сильному збовтуванні, для того, щоб поверхня
осаду була максимально великою. Можна додати розчин крохмалю.
4. Титрування неможливо проводити на прямому сонячному світлі, тому що
адсорбовані барвники сильно підвищують чутливість солей до світла.
При виконанні методу Фаянса:
Точну наважку речовини (КІ, NaІ) розчиняють в 20-30 мл води додають 1,5 мл розведеної оцтової кислоти, 5 крапель 0,1 % розчину еозинату натрію і титрують 0,1 моль /л розчином AgNO3 до переходу забарвлення осаду в рожевий колір.
Титрування цим методом неможливо проводити в лужному середовищі (випадає осад Ag2O)
Таблиця 2. Аргентометричне титрування по методу Фаянса.
4. Метод Фольгарда.
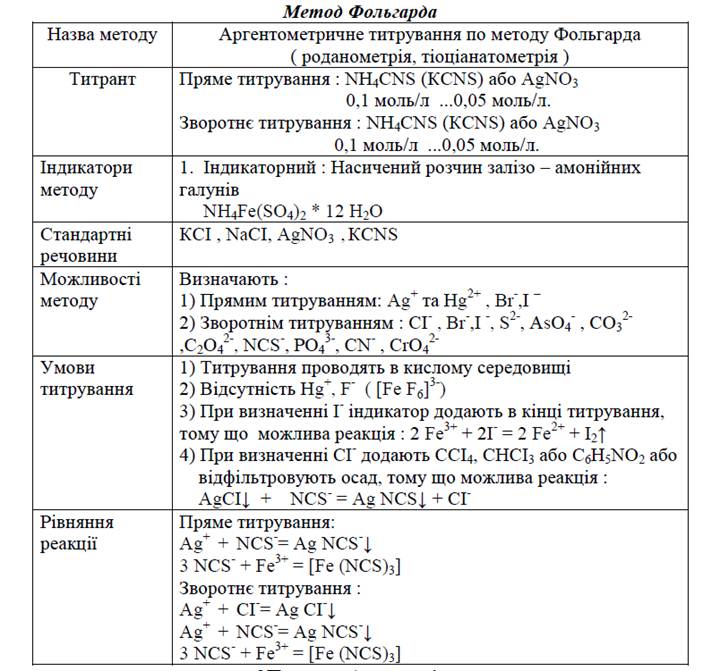
Метод Фольгарда базується на реакції осадження йонів Ag+ йонами СNS-
Ag+ + СNS- = AgСNS↓
Метод Фольгарда застосовується для кількісного визначення солей СNS-, Ag+, HaI-
Робочими титрованими розчинами в цьому методі є:AgNO3, NН4СNS, КСNS.
Кінець реакції осадження встановлюють за допомогою індикатора–залізо – амонійних галунів NH4Fe(SO4)2 * 12 H2O, підкисленого нітратною кислотою.
Кінцеву крапку титрування визначають по утворенню розчинного у воді Fe(СNS)3, який забарвлений у червоний колір
Fe 3+ + СNS-= Fe(СNS)3
До тих пір, коли в розчині містяться йони Ag+, при додаванні СNS- утворюється білий нерозчинний осад AgСNS. В той момент, коли всі йони Ag+ зв’яжуться з СNS- йонами (в момент еквівалентності) утворюється Fe(СNS)3 та розчин забарвлюється в червоний колір.
Визначення вмісту Ag+ та Нg22+ проводять прямим титруванням розчином NН4СNS (КСNS).
При визначенні солей галогенідів застосовують метод зворотнього титрування, тому що HaI- не реагують з СNS-.
При зворотньому титруванні до титруємого розчину солі галогену додають точно відміряну кількість нітрату аргентуму (взяту у надлишку).
Частина AgNO3 реагує з HaI-, утворюючи при цьому осад AgHaI↓. Надлишок аргентуму відтитровують NН4СNS в присутності залізо - амонійних галунів.
Титрування ведуть до появи слабкого чернуватого забарвлення, стійкого при нетривалому перемішуванні розчину. Кількість AgNO3, яка пішла на взаємодію з NaСІ, визначають як різницю між взятим AgNO3 та залишившимся у надлишку.
Переваги метода Фольгарда перед методом Мора в тому, що він може застосовуватись як в нейтральному так і в кислому середовищі. Наявність у розчині вільних кислот сприяє отриманню більш точних результатів. Йони барію, плюмбуму, вісмуту не заважають проведенню аналізу, тому метод Фольгарда застосовується більше ніж метод Мора.
В лужному середовищі Fe3+ утворюють осад Fe (ОН)3, тому в лужному середовищі можна визначати тільки після нейтралізації нітратною кислотою.
Титрування по методу Фольгарда неможливо в присутності окисників, тому що вони руйнують йони СNS-, а також в присутності Нg2+ Нg22+, які осаджують йони СNS-.
В незалежності від того, яку речовину аналізують – солі аргентума або роданіди – титрування за методом Фольгарда проводять завжди в такій послідовності:
В конічну колбу наливають визначаємій об’єм AgNO3 2 – 3 мл залізо - амонійних галунів, та титрують роданідом амонію до утворення незникаючого червонуватого забарвлення розчину.
В клінічних дослідженнях метод Фольгарда застосовують - для визначення хлоридів у крові.
В фармацевтичному аналізі застосовується - для кількісного визначення йодидів калію і натрію, визначення вмісту брому в бромкамфорі після мінералізації.
Таблиця 3. Аргентометричне титрування по методу Фольгарда
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 7571; Нарушение авторских прав?; Мы поможем в написании вашей работы!