
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод окислення - відновлення
Лекція №13
Питання до самостійного вивчення
Контролі запитання
1. Як класифікують методи осаджувального титрування.
2. Яким умовам повинна відповідати реакція осадження, щоб її можна було
використовувати для кількісного аналізу.
3. На чому ґрунтуються застосування хромату калію як індикатора в методі Мора.
4. Чому метод Мора проводять в нейтральному або слабо лужному середовищі.
5. Як зберігають розчин нітрату аргентуму?
6. Стандартні розчини в методі Мора.
7. Які йони заважають проведенню аналізу методом Мора
8. Суть методу Фаянсу
9. Суть методу Фольгарда
10. Титранти методу Фольгарда
11. Індикатори методу Фольгарда (записати рівняння)
12. Умови на яких проводиться метод Фольгарда
13. Переваги методу Фольгарда по зрівнянню з методом Мора
Література:
Основна:
1. «Технічний аналіз» Іванова З.І., Савостін А.П. М., «Металургія», 1981.280 с.
2. « Хімічний аналіз в металургії» П.П. Коростельов., М., «Металургія» 1988. 384 с.
3. «Курс аналітичної хімії» Книга перша. Кількісний аналіз. Під.ред. А.П. Крешкова. М., «Хімія», 1975р.
Додаткова:
Л – 1: Аналітична хімія. Підручник для вищих навчальних закладів / А.С. Алемасова, В.М. Зайцев, Л.Я. Єнальєва, Н.Д. Щепіна, С.М. Гождзінський / Під ред. В.М. Зайцева. – Донецьк: 2010. – 417 с.
1. Спосіб просвітлення та рівного помутніння.
А.П. Крешков, А.А. Ярославец «Курс аналитической химии» 2 том, 1975г. с.-230-231
Зміст
1. Сутність та класифікація методів окислювально-відновного титрування.
2. Індикатори окисно-відновного титрування.
3. Перманганатометрія.
4. Йодометрія.
5. Хроматометрія.
6. Ванадометрія.
7. Церіметрія.
8. Тітанометрія.
Контрольні питання
Література
Питання до самостійного вивчення
Викладач Ю.В. Старушенко
1. Сутність та класифікація методів окислювально-відновного титрування.
Методи редоксометріі засновані на реакціях окислення - відновлення. Розроблено дуже багато методів. Їх класифікують відповідно до застосовуваного стандартного (робочого, титранту) розчину. Найбільш часто застосовуються такі методи:
Перманганатометрія - метод, який заснований на окислювальній здатності робочого розчину перманганату калію KМnO4. Титрування ведеться без індикатора. Застосовується для визначення тільки відновників при прямому титруванні.
Іодометрія - метод, в якому робочим розчином служить розчин вільного йоду в КI. Метод дозволяє визначати як окислювачі, так і відновники. Індикатором служить крохмаль.
Хроматометрія заснована на використанні в якості робочого розчину дихромату калію K2Cr2O7. Метод може застосовуватися як для прямих так і непрямих визначень відновників.
Броматометрія заснована на використанні в якості титранту бромата калію KBrO3 при визначенні відновників.
Іодатометрія застосовує в якості робочого розчину розчин иодата калію KIO3 при визначенні відновників.
Ванадатометрія дає можливість використовувати окислювальну здатність ванадати аммоноя NH4VO3. Крім перерахованих методів в лабораторній практиці використовуються і такі методи як церіметрія (Ce4 +), тітанометрія та інші.
Для обчислення молярної маси еквівалента окислювачів або відновлювачів враховується число електронів, що приймають участь в окисно-відновній реакції (Ме = М / ne, де n - число електронів е). Для визначення числа електронів необхідно знати початкову та кінцеву ступінь окислення окислювача і відновника.
З великої кількості окислювально-відновних реакцій для хімічного аналізу використовують тільки ті реакції, які:
• протікають до кінця;
• проходять швидко і стехіометрічно;
• утворять продукти визначеного хімічного складу (формули);
• дозволяють точно фіксувати точку еквівалентності;
• не вступають в реакцію з побічними продуктами, присутніми в досліджуваному розчині.
Найбільш важливими чинниками, що роблять вплив на швидкість реакції, є:
• концентрація реагуючих речовин;
• температура;
• значення рН розчину;
• присутність каталізатора.
У більшості випадків швидкість реакції знаходиться в прямій залежності від температури і рН розчину. Тому багато визначення методом окисно-відновного титрування слід проводити при певному значенні рН і при нагріванні.
2. Індикатори окисно-відновного титрування.
При аналізі методами окисно-відновного титрування використовується пряме, зворотне і замісне титрування. Точка еквівалентності окисно-відновного титрування фіксується як за допомогою індикаторів, так і безіндікаторним способом. Безіндікаторний спосіб застосовується в тих випадках, коли окислена і відновлена форми титранту відрізняються. У точці еквівалентності, при введенні 1 краплі надлишку розчину титранту змінюється забарвлення розчину. Безіндікаторним способом можна проводити визначення перманганатометричним методом, тому в точці еквівалентності від однієї краплі розчину перманганату калію розчин окрашується в блідорожевий колір.
При индикаторному способі для фіксування точки еквівалентності застосовують специфічні і редоксіндікатори. До специфічних індикаторів відноситься крохмаль в іодометріі, який у присутності вільного йоду забарвлюється в інтенсивно-синій колір внаслідок утворення адсорбційного з'єднання синього кольору. Редокс-індикатори - це речовини, у яких забарвлення змінюється при досягненні певного значення окислювально-відновного (редокспотенціала). Найбільш часто використовують такі окисно-відновні індикатори:
Дифеніламін

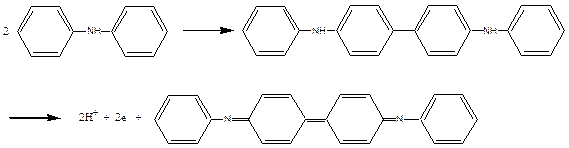
Дифеніламін застосовується при титруванні розчином K2Cr2O7, ванадатом амонію NH4VO3, дуже розведеними розчинами KMnО4.
Дифеніламінсульфокислота
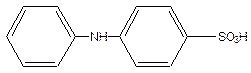
Фенілантранілова кислота – це карбонільне похідне дифеніламіну:
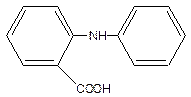
Механізм її перетворення аналогічний дифеніламіну. Відновлена форма цього індикатора – безбарвна, окислена – червоно-фіолетова.
Фероїн – комплекс Fe(III) з о-фенантроліном:
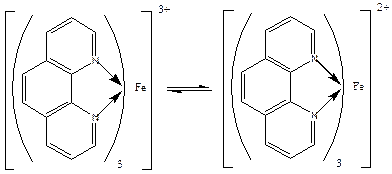
окислена форма відновлена форма
синій колір червоний колір
До Редокс-індикаторів висувають такі вимоги:
• фарбування окисленої і відновленої форми повинна бути різна;
• зміна кольору повинно бути помітно при невеликій кількості індикатора;
• індикатор повинен реагувати в точці еквівалентності з вельми невеликим надлишком відновлювача або окислювача;
• інтервал дії його повинен бути якомога менше;
• індикатор повинен бути стійкий до впливу компонентів навколишнього середовища (О2, повітря, СО2, світла і т.п.).
3. Перманганатометрія.
В основі перманганатометрії лежить реакція окислення різних відновників робочим розчином перманганату калію, тобто іоном MnO4-. Окислення перманганатом калію можна проводити в кислому, нейтральному і в лужному середовищі
У сильнокислому середовищі перманганат-іони (МnО4-) володіють високим окислювально-відновним потенціалом, відновлюючись до Мn2+, і їх застосовують для визначення багатьох відновників:
МnО4-+ 8Н + + 5е = Мn2+ + 4Н2О
У лужному середовищі МnО4-відновлюється до манганат іона:
МnО4-+ е = МnО42-
У нейтральній чи слаболуговому середовищі перманганат іон відновлюється до MnO2:
МnО4-+ 2Н2О + 3е = МnО2 ↓ + 4ОН-
При титруванні перманганатом не застосовують індикатори, так як реагент сам пофарбований і є чутливим індикатором: 0,1 мл 0,01 М розчину КМnО4 забарвлює 100 мл води в блідо-рожевий колір. У результаті реакції перманганату калію з відновлювачем в кислому середовищі утворюються безбарвні іони Мn2+, що дозволяє чітко фіксувати точку еквівалентності.
Розчин КМnО4 відноситься до титранту з встановленим титром. У зв'язку з цим перед використанням його в аналізі в якості титранту розчин КМnО4 стандартизують по концентрації розчинів вихідних речовин шавелевої кислоти або оксалату натрію. Розчин перманганату калію дуже важко отримати у чистому вигляді. Зазвичай він забруднений слідами оксиду марганцю (IV). Крім того, чиста дистильована вода зазвичай містить сліди речовин, які відновлюють перманганат калію з утворенням оксиду марганцю (IV):
4 КМnО4 + 2Н2О = 4 МnО2 ↓ + 4ОН-+ 3О2
При зберіганні в твердому вигляді перманганат калію розкладається під дією світла, забруднюючи також МnО2:
КМnО4 = К2МnО4 + МnО2 ↓ + О2
Розчин перманганату калію може бути приготований з стандарт - титру та по наважці взятої на технічних вагах. У першому випадку вміст ампули кількісно переноситься в мірну колбу місткістю 2л, ополіскуя ампулу і воронку теплою дистильованою водою. Внести в мірну колбу невеликий об'єм гарячої води для розчинення кристалів, потім отриманий розчин охолодити до кімнатної температури, об'єм розчину довести до мітки і пермешують. Молярна концентрація отриманого розчину становить 0,05 моль / л.
У другому випадку на технічних вагах у бюксі або на годинному склі відважити наважку перманганату калію масою 1,6 г, помістити її в хімічний стакан і розчиняти в гарячій дистильованій воді при ретельному перемішуванні утворюється розчину, намагаючись, щоб всі кристали КМnО4 розчинилися. Потім розчин обережно злити через лійку в мірну колбу місткістю 1 л і ретельно перемішати, попередньо закривши колбу притертою пробкою (гумову пробку не використовувати). Приготовлений розчин КМnО4 залишити на 7-10 днів, потім відфільтрувати розчин через лійку зі скляною ватою або обережно злити в іншу склянку за допомогою сифона. Зберігати розчин КМnО4 обов'язково в темних склянках, захищених від світла, щоб попередити розкладання.
Установку титру розчину перманганату калію, приготованого по взятої наважки, можна проводити по щавлевої кислоти Н2С2О4 * 2Н2О або оксалату натрію Na2C2O4.
4. Йодометрія.
Іодометричний метод титриметричного аналізу заснований на реакції:
I2 + 2e = 2I-
Це рівняння записано схематично, так як в практиці для збільшення розчинності I2 використовують розчин КI, який з I2 утворює комплекс К [I3]. Тоді рівняння іодометрічного визначення виглядає так:
I3-+ 2e ↔ 3I-
Про кількість визначаємої речовини судять за кількістю поглиненого або виділеного йоду. Речовини, окислювально-відновний потенціал яких нижчий 0,545 В, будуть відновниками (SO2, Na2S2O3, SnCl2 та ін) і, отже, буде протікати реакція з поглинанням йоду. Рівновага буде зміщений вправо. Речовини, окислювально-відновний потенціал яких буде більше 0,545 В, будуть окислювачами (KMnO4, MnO2, K2Cr2O7, Cl2, Br2 та ін) і направляти реакцію вліво, у бік виділення вільного йоду.
У зв'язку з цим іодометричний метод застосовується як для визначення відновників, так і окислювачів. Іодометричне визначення проводяться в кислому середовищі, так як в лужному середовищі може утворитися гіпоіодід іон, окислювальна здатність якого вища, ніж йоду, що може сприяти протіканню побічних процесів, зокрема окисляти тіосульфат іон до сульфату і результати будуть спотворені.
При визначенні сильних відновників (Ео набагато більше 0,545 В) застосовується пряме титрування, а слабких (Ео близько до 0,545 В) - зворотне титрування. Робочим розчином (титрант) служить розчин I2. Окислювачі визначаються тільки способом замісного титрування, тому при використанні в якості робочого розчину йодиду калію неможливо зафіксувати точку еквівалентності (момент припинення виділення йоду). В якості титранту при визначенні окисників застосовується розчин тіосульфату натрію, який взаємодіє з виділом йодом (заступник) в еквівалентній кількості.
В якості індикатора в йодометрії застосовують свіжоприготовлений 1%-ний розчин крохмалю. При взаємодії крохмалю з йодом протікають 2 процеси - комплексоутворення та адсорбція, в результаті яких утворюється з'єднання синього кольору. Чутливість реакції з крохмалем велика, але різко падає з підвищенням температури.
5. Хроматометрія.
Хроматометричне титрування - один з методів окисно-відновного титрування, оснований на використанні дихромату калію К2Сr2О7 в якості окислювача. При дії на відновники дихромат-іон Сr2О72-набуває шість електронів і відновлюється до Сr3+
Сr2О72-+ 6е + 14Н+ = 2Сr3+ + 7Н2О
Отже, молярна маса еквівалента дихромату калію дорівнює 1/6 молярної маси. З рівняння реакції видно, що відновлення аніонів Сr2О72-до катіонів Сr3+ відбувається в присутності іонів Н+.
Тому титрують дихроматом в кислому середовищі. В кислому середовищі дихромат калію є сильним окислювачем. Тому діхроматометрію успішно застосовують для визначення майже всіх відновників, що визначаються перманганатометрично. Діхроматометрія має навіть деякі переваги перед перманганатометрія.
Дихромат калію легко отримати в хімічно чистому вигляді перекристалізацією. Тому стандартний розчин його готують розчиненням точної наважки. Розчини дихромату калію надзвичайно стійкі при зберіганні в закритих посудинах; він не розкладається навіть при кип'ятінні підкисленого розчину і практично не змінюється при стоянні розчину.
Крім того, дихромат калію важче ніж перманганат, відновлюється органічними речовинами. Тому він не окисляє випадкові домішки органічних речовин. Цим також обумовлюється сталість його титру в розчині. Дихромат калію не окисляє (без нагрівання) хлорид-іони. Це дозволяє титрувати їм відновники в присутності НСl.
Індикатором при діхроматометричному титруванні найчастіше служить дифеніламін, що забарвлює розчин в синій колір при найменшому надлишку дихромату. Дифеніламін відноситься до групи так званих редокс-індикаторів (окисно-відновних індикаторів). Вони являють собою окислювально-відновні системи, змінюють забарвлення при переході відновленої форми в окислених, або навпаки.
Кожен окислювально-відновний індикатор характеризується певним окисно-відновним потенціалом. Для дефеніламіна він становить +0,76 В. Окислена форма діфеніламіна пофарбована в синій колір, а відновлена - безбарвна.
Діхроматометрично визначають іони Fe2+ в розчинах НСl або в сірчанокислих розчинах. Хлорид-іони не заважають визначенню, якщо концентрація їх не перевищує 1 моль / л.
Однак при титруванні солей Fe2+ дихроматом в розчині накопичуються катіони Fe3+, окислювально-відновний потенціал системи підвищується і дифеніламін окислюється. Тому синє забарвлення може з'явитися, коли точка еквівалентності ще не досягнута.
Щоб знизити окислювально-відновний потенціал системи, до розчину крім діфеніламіну і соляної кислоти додають ще ортофосфорну кислоту. Остання маскує заважають іони Fe3+, пов'язуючи їх в міцний безбарвний комплекс Fe (HPО4)+.
6. Ванадометрія.
Цей метод окисно-відновного титрування заснований на реакції відновлення аналізованої речовини сульфатом ванадію (II), який окислюється при цьому до ванадію (III):
V2+ -е = V3+
У ванадометріі використовують два робочих розчину - розчин сульфату ванадію (II) VS04 і розчин залізо квасцов NH4Fe (SО4)2.
Аналітичні визначення виконують зазвичай методом зворотного титрування. До аналізованого розчину додають надлишок титрованого розчину сульфату ванадію і потім оттитровують сульфат ванадію, який не увійшов в реакцію, титруваним розчином залізо квасцов. При цьому протікає реакція
2VS04 + 2NH4Fe(SО4)2 = V2(SО4)3 + 2FeSО4 + (NH4)2SО4
За кількістю відтитрованого сульфату ванадію обчислюють вміст аналізованої речовини. Для визначення точки еквівалентності використовується окислювально-відновний індикатор сафранін, безбарвний в присутності іонів V2+ і забарвлюється в червоний колір від першої краплі надлишку окислювача - залізо квасцов (мал..1).
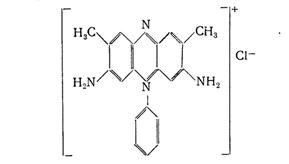
Малюнок 1. Окислювально-відновний індикатор сафранін.
7. Церіметрія.
Метод заснований на окисленні аналізованого речовину солями чотирьохвалентного церію, який відновлюється при цьому до трьохвалентного:
Се4+ + е = Се3+
В якості з'єднання чотирьохвалентного церію використовують його змішану сіль Ce(SO4)2*2(NH4)2SO4*2H2O. Титр робочого розчину встановлюють по оксалату натрію.
Аналіз зазвичай ведуть прямим титруванням. Точку еквівалентності визначають по виникненню жовтого забарвлення розчину: солі тривалентного церію безбарвні, а солі чотирьохвалентного церію забарвлені в жовтий колір.
8. Титанометрія.
Цей метод заснований на відновленні аналізованої речовини сульфатом титану (III). При цьому титан (III) окислюється до титану (IV):
Ті3+ -е = Ті4+
В якості робочого розчину використовують розчин сульфату титану (III), титр якого встановлюють по розчину перманганату.
|
|
Дата добавления: 2014-01-05; Просмотров: 4233; Нарушение авторских прав?; Мы поможем в написании вашей работы!