
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики. Энтропия
Можно сформулировать следующее положение: все процессы, ведущие к состоянию теплового равновесия, являются необратимыми. Когда тепловое равновесие достигнуто, все тепловые процессы прекращаются.
Следовательно, для того, чтобы в равновесной системе произвести какую-либо работу необходимо внешнее воздействие, выводящее систему из теплового равновесия.
Этот вывод формулируется в виде второго начала термодинамики: с помощью тел, находящихся в тепловом равновесии, невозможно произвести никакой работы.
Следствием второго начала термодинамики является невозможность создания вечного двигателя второго рода, т.е. двигателя, совершающего работу за счет энергии окружающих его тел, имеющих большой запас энергии, но находящихся в тепловом равновесии с ним. Земля не находится в состоянии теплового равновесия, на Земле продолжают происходить тепловые процессы.
Количественно, стремление тела перейти в другое тепловое состояние, характеризуется числом микроскопических способов, которыми этот переход может быть осуществлен. Это число называется статистическим весом 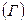 . Тело, предоставленное самому себе, стремится перейти в состояние с большим статистическим весом. Величина, равная произведению постоянной Больцмана на логарифм от статистического веса называется энтропией
. Тело, предоставленное самому себе, стремится перейти в состояние с большим статистическим весом. Величина, равная произведению постоянной Больцмана на логарифм от статистического веса называется энтропией 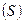 :
:
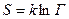 .
.
Пример. Число способов 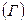 , которыми может быть реализовано данное состояние системы, состоящей из двух тел, равно
, которыми может быть реализовано данное состояние системы, состоящей из двух тел, равно 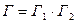 , где
, где 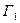 и
и 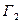 число способов перехода в данное состояние каждого из тел. Следовательно,
число способов перехода в данное состояние каждого из тел. Следовательно, 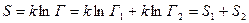 . Мы видим, что энтропия сложной системы равна сумме энтропий каждого тела ее составляющего.
. Мы видим, что энтропия сложной системы равна сумме энтропий каждого тела ее составляющего.
Закон, определяющий направление протекания тепловых процессов можно сформулировать как закон возрастания энтропии. Все тепловые процессы ведут к возрастанию энтропии. Энтропия достигает своего максимального значения при достижении состояния теплового равновесия. Это более точная формулировка второго начала термодинамики, фактически отображающего направление развития тепловых процессов.
|
Дата добавления: 2014-01-05; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!