
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метаболизм лекарственных веществ
 |
Концентрация лекарства в организме существенно зависит от метаболизма лекарственных веществ. Большинство из них подвергаются в организме либо частичному, либо почти полному превращению.
Только немногие вещества покидают организм в неизмененном виде (к их числу относят окись углерода, закись азота, в значительной части хлороформ и этиловый эфир и др.).
Превращение лекарственных веществ может идти как по пути разрушения молекул (упрощения структуры молекулы вещества – этап модификации), так и в направлении ее усложнения в результате конъюгации (связывания с эндогенными веществами). Превращение молекулы лекарственного вещества зачастую включает обе эти фазы. В первой фазе модификации структура лекарственного вещества в результате реакций окисления, восстановления, гидролиза упрощается и в ней появляются новые функциональные группы
(-СООН; -ОН; -NН2; -SН и др.), повышающее ее полярность. Во второй фазе в результате процессов конъюгации (с глюкуроновой, серной, уксусной кислотами, метильными и др. алкильными группами) происходит усложнение молекулы лекарственного вещества, блокирование функциональных групп, снижение липидорастворимости, повышение или понижение активности (токсичности) вещества.
В последующем при конъюгации лекарственное вещество или его метаболиты соединяются с эндогенными молекулами или группировками (глюкуроновой кислотой, серной кислотой, уксусной кислотой, аминокислотами, метильными или другими алкильными группировками), происходит блокирование функциональных групп (например, -СООН, -ОН,
-NH2, S-H и др.) и дезактивация молекулы.
Некоторые лекарственные вещества метаболизируются в течение одной фазы конъюгации, если изначально обладают функциональными группами, способными связываться с эндогенными веществами.
|
|
|
В процессе метаболизма лекарств в организме, наряду со структурой, меняется и их фармакологическая активность. Она может:
- усиливаться;
- изменять характер;
- появляться токсичность;
В основном лекарственное вещество подвергается дезактивации.
В качестве примера усиления активности вещества в процессе метаболизма можно привести образование из имипрамина дезметилимипрамина, обладающего выраженной способностью ослаблять депрессивные состояния при психических заболеваниях.
В качестве примера изменения характера активности вещества можно привести метаболизм ипрониазида – антидепрессанта, который в результате дезалкилирования превращается в изониазид, обладающий противотуберкулезным действием.
В качестве примера усиления токсичности при метаболизме лекарственного вещества может служить образование из фенацетина (жаропонижающее, болеутоляющее и противовоспалительное средство) парафенитидина, вызывающего гипоксию за счет образования метгемоглобина.
В основном метаболизация приводит к детоксикации, дезактивации лекарственного вещества, происходящего путем различных химических превращений. В качестве примера дезактивации путем гидроксилирования можно привести превращения люминала (фенобарбитала) в параоксифенил – этилбарбитуровую кислоту.
В качестве примера дезактивации лекарственного вещества путем конъюгации с уксусной кислотой можно привести превращение сульфаниламидов в ацетилированное производное.
В конечном итоге в результате метаболизации лекарственных веществ имеет место падение или исчезновение липидорастворимости и фармакологической активности, возрастание полярности их молекул, повышение растворимости в воде и, как следствие этого, ускорение их выведения из организма с мочой.
|
|
|
В организме не существует биохимической системы или органа, предназначенного только для метаболизма лекарств.
В основном метаболизация и инактивация лекарственных веществ осуществляется в печени с участием ферментов, локализированных в эндоплазматическом ретикулуме (микросомах). В метаболизации лекарств участвуют также микросомальные ферменты легких, кожи, желудочно-кишечного тракта и др. тканей. Микросомальные ферменты не метаболизируют (за редким исключением) эндогенные соединения, а в основном, метаболизируют чужеродные химические вещества, в том числе лекарственные.
Вне эндоплазматического ретикулюма биотрансформация лекарственных веществ происходит в лизосомах, митохондриях, пероксисомах и в цитозоле клеток. Превращение лекарств может происходить также во внеклеточных жидкостях (крови, лимфе, ликворе, межклеточной жидкости) и в полости желудочно-кишечного тракта, в основном, путем гидролиза. Ряд лекарственных веществ может также метаболизироваться некоторыми ферментами межуточного обмена, такими как алкогольдегидрогеназа, альдегиддегидрогеназа, ксантиноксидазы, эстеразы, моноаминооксидазы и др. К числу этих лекарственных веществ относятся гормоны, витамины, моноамины (серотонин, гистамин, ацетилхолин, адреналин и др.), жирные кислоты (линетол и др.), простагладины, пуриновые и пиримидиновые основания (аденин и др.), нуклеозиды и др. препараты, являющиеся метаболитами и субстратами нормального межуточного обмена и не являющиеся ксенобиотиками.
Учитывая существенную роль ферментов эндоплазматического ретикулюма в инактивации чужеродных веществ, метаболические превращения лекарственных веществ подразделяют на превращения, которые катализируются микросомальными ферментами печени (и, возможно, ферментами других тканей) и на превращения, которые катализируются ферментами, локализованными в других частях клетки (немикросомальные).
В состав микросомальных ферментов входят оксидазы со смешанными функциями (их еще называют микросомальными монооксигеназами или ферментами свободного окисления), а также различные эстеразы (глюкозо-6-фосфатаза, магний-зависимые нуклеозидфосфатазы, неспецифические эстеразы), ферменты синтеза белков, липидов, фосфолипидов, гликопротеидов, желчных кислот, наконец, ферменты, катализирующие реакции конъюгации. Из их числа в механизмах детоксикации ксенобиотиков (и в том числе лекарств) участвуют:
|
|
|
- оксидазы со смешанными функциями (т.е. микросомальные оксигеназы);
- эстеразы;
- ферменты конъюгации.
Таким образом микросомальные ферменты, в основном, осуществляют окисление, восстановление, гидролиз и конъюгацию ксенобиотиков (в т.ч. лекарств).
Микросомальные монооксигеназы катализируют биотрансформацию преимущественно липотропных ксенобиотиков, а ткаже эндогенных стероидов, ненасыщенных жирных кислот, простагландинов. Эти монооксигеназы, участвуя в метаболизме липотропных ядов и лекарственных веществ, катализируют такие реакции окисления, как С-гидроксилирование в алифатической цепи, в ароматическом и алициклическом кольцах, в алкильных боковых цепях, N-гидроксилирование, O-, N-, S-дезалкилирование, окислительное дезаминирование, дезамидирование и эпоксидирование.
Помимо окислительных превращений, эти ферменты катализируют реакции восстановления ароматических нитро- и азосоединений, реакции восстановительного дегалогенирования. В результате этих реакций ксенобиотики приобретают реактивные группы - -ОН, -СООН, -NН2, -SН и др. Образующиеся таким путем метаболиты легко вступают в реакцию конъюгации с образованием малотоксичных соединений, которые затем выводятся из организма, в основном с мочой, желчью и калом.
Микросомальные монооксигеназы представляют собой полиферментный комплекс, локализованный на гладком эндоплазматическом ретикулуме и связанный с двумя внемитохондриальными цепями переноса электронов, генерирующих восстановленные формы НАДФ и НАД. Источником НАДФ.Н2 служит главным образом пентозофосфатный цикл, а НАД.Н2 - гликолиз.
Общим самоокисляющимся (аутооксидабельным) звеном этих полифемерментных комплексов является цитохром Р-450. В состав этого комплекса входят также цитохром в5, НАДФ.Н-цитохром-Р-450-редуктаза (ФП1) и НАД.Н-цитохром в5-редуктаза (ФП2).
|
|
|
Цитохром Р450 представляет собой гемсодержащий белок, широко распространенный в тканях животных и растений. Он локализован в глубоких слоях мембран эндоплазматической сети. При взаимодействии с СО восстановленный цитохром образует карбонильный комплекс, характеризующийся полосой поглощения при 450 нм, что и определило название фермента. Цитохрому Р450 присуще многообразие изоформ и широта субстратной специфичности. Эту широту субстратной специфичности характеризуют как специфичность к гидрофобности веществ.
Цитохром Р450 является важнейшим компонентом микросомальной монооксигеназной системы. Этот фермент отвечает за активацию молекулярного кислорода (путем переноса на него электронов) и за связывание субстрата. Цитохром Р450 использует активированный кислород для окисления субстрата и образования воды.
Другой компонент микросомальной монооксигеназной системы НАДФ*Н2 цитохромР450редуктаза (ФП1) служит переносчиком электронов с НАДФ*Н2 на цитохром Р450. Этот фермент - флавопротеид, содержащий ФАД и ФМН, связан с фракцией поверхностных мембранных белков эндоплазматического ретикулума. Этот фермент способен передавать электроны не только на цитохром Р450, но и на другие акцепторы (на цитохром в5, цитохром с).
Цитохром в5 представляет собой гемопротеид, который, в отличие от цитохрома Р450, локализирован в основном на поверхности мембран эндоплазматического ретикулума. Цитохром в5 способен получать электроны не только от НАДФ*Н2, но и от НАД*Н2 участвуя в функционировании НАД*Н2-зависимой цепи транспорта электронов.
В состав этой цепи также входит фермент НАД*Н2-цитохром-В5-редуктаза (ФП2).
Этот фермент, так же как и цитохром В5, не фиксирован строго на определенных участках мембраны эндоплазматической сети, а способен менять свою локализацию, передавая электроны с НАД*Н2 на цитохром В5.
В процессе метаболизма ксенобиотиков, где ведущую роль играют НАДФ*Н2-зависимые реакции, имеет место взаимодействие НАДФ*Н2 и НФД*Н2-зависимых цепей. Установлена тесная функциональная связь цитохромов Р450 и В5. Они могут образовывать сложные гемпротеидные комплексы, что обеспечивает высокую скорость катализируемых ими реакций превращения ксенобиотиков.
Среди схем биотрансформации ксенобиотиков под воздействием монооксигеназ наибольшее распространение получила схема Эстабрука, Гильденбрандта и Барона. Согласно этой схеме предполагается, что вещество –SH (в том числе – лекарство) на первой стадии взаимодействует с окисленной формой цитохрома Р450 (Fe3+) с образованием фермент-субстратного комплекса (SH-Fe3+). На второй стадии фермент-субстратный комплекс восстанавливается электроном, поступающим от НАДФ*Н2 посредством НАДФ*Н2-цитохромР450-редуктазы (ФП1) при возможном участии цитохрома В5. Образуется восстановленный фермент-субстратный комплекс (SH-Fe2+). Третья стадия характеризуется взаимодействием восстановленного фермент-субстратного комплекса с кислородом с образованием трехкомпонентного комплекса SH-Fe2+-О2. Присоединение кислорода осуществляется с большой скоростью. На четвертой стадии тройной фермент-субстрат-кислородный комплекс восстанавливается вторым электроном, который, по-видимому, поступает из НАД*Н2-специфической цепи переноса, включающей НАД*Н2-цитохром-В5-редуктазу (ФП2) и, возможно, цитохром В5. Образуется восстановленный комплекс SH-Fe2+-О21-.
Пятая стадия характеризуется внутримолекулярными превращениями восстановленного тройного фермент-субстрат-кислородного комплекса (SH-Fe2+-О21-↔ SH-Fe3+-О22-) и его распадом с освобождением воды и гидроксилированного субстрата. При этом цитохром Р450 переходит в исходную окисленную форму.
При функционировании монооксигеназ генерируются активные радикалы, в первую очередь - супероксидный анион (О2-): тройной фермент-субстрат-кислородный комплекс до восстановления вторым электроном может вступать в обратимую реакцию превращения в окисленный фермент-субстратный комплекс и при этом генерируется супероксидный анион О2-.
Схему Эстабрука, Гильденбрандта и Барона можно представить следующим образом:
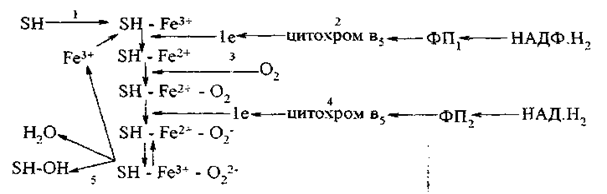
В отличие от митохондриальной дыхательной цепи, в которой молекулярный кислород, являющийся непосредственным акцептором электронов на последнем участке цепи, идет только на образование воды, в микросомальной монооксигеназной системе, наряду с образованием воды (на которое расходуется один атом кислорода), осуществляется при посредстве цитохрома Р450 непосредственное присоединение кислорода (его второго атома) к окисляемому субстрату (лекарственному веществу) и происходит его гидроксилирование.
Кроме того, в отличие от митохондриальной цепи, где энергия, освобождающаяся в процессе переноса электронов, реализуется в виде АТФ на трех участках дыхательной цепи благодаря сопряжению окисления с фосфорилированием, в микросомальной цепи энергия окисления вообще не освобождается, а используется лишь редуцирующие эквиваленты НАДФ*Н2, необходимые для восстановления кислорода до воды. Поэтому окислительное гидроксилирование рассматривают, как свободное (т.е. не сопровождаемое образованием АТФ окисление).
Микросомальные монооксигеназные системы катализируют различные реакции окислительного превращения липотропных ксенобиотиков, в том числе лекарств. Наибольшее значение придается следующим окислительным реакциям превращения лекарственных веществ:
1) гидроксилированию ароматических соединений (например: салициловая кислота→ гентизиновая кислота → диокси- и триоксибензойная кислоты);
2) гидроксилированию алифатических соединений (например: мепробамат → кетомепробамат);
3) окислительному дезаминированию (например: фенамин → бензойная кислота);
4) S-дезалкилированию (например: 6-метилтиопурин → 6-тиопурин);
5) О-дезалкилированию (например: фенацетин → параацетамидофенол);
6) N-дезалкилированию (например: ипрониазид → изониазид);
7) сульфоокислению (например: тиобарбитал → барбитал);
8) N-окислению (например: диметиланилин → N-окись диметиланилина).
Помимо окислительных ферментных систем эндоплазматический ретикулюм печени содержит восстановительные ферменты. Эти ферменты катализируют восстановление ароматических нитро- и азосоединений в амиды. По химической природе восстановительные ферменты являются флавопротеидами, у которых простетической группой является ФАД. В качестве примера можно привести восстановление пронтозина в сульфаниламид.
Микросомальные ферменты печени (эстеразы) принимают участие также в реакциях гидролиза лекарственных веществ (сложных эфиров и амидов). Гидролиз – очень важный путь инактивации многих препаратов. В качестве примера может служить превращения ацетилсалициловой кислоты (сложный эфир) в салициловую кислоту и уксусную кислоту; ипрониазида (амид) в изоникотиновую кислоту и изопропилгидрозин, метаболизирующихся, в основном, путем гидролиза.
Некоторые лекарственные вещества метаболизируются в организме и посредством немикросомальных ферментов. Биотрансформация лекарств может происходить в митохондриях, лизосомах, пероксисомах, цитозоле клеток. Кроме того, метаболизм лекарств может осуществляться и во внеклеточных жидкостях (крови, лимфе, ликворе, межклеточной жидкости), а также в полости желудочно-кишечного тракта.
В большинстве своем немикросомальные ферменты метаболизируют лекарственные вещества, являющиеся нормальными субстратами и метаболитами организма (гормоны, витамины, амины и др.).
Существенное место в превращениях лекарственных веществ в организме принадлежит конъюгационным механизмам. Конъюгация, являясь второй фазой метаболизма лекарств, представляет собой биосинтез, при котором лекарственные вещества и их метаболиты, соединяются с эндогенными соединениями, такими, как глюкуроновая кислота, сульфат, ацетил, метил, глицин и др. Различные лекарственные вещества конъюгируются с различными соединениями.
Присоединение эндогенных соединений происходит к функциональной группе лекарственных веществ или его метаболита (гидроксильной, аминной, карбоксильной группе, атому галогена и др.), что приводит к повышению его полярности и растворимости в воде и снижению липидорастворимости и токсичности. Все это облегчает выделение конъюгатов из организма. При образовании конъюгатов эндогенные соединения, переносимые с помощью специфических ферментов на лекарственные вещества (значительно реже – сами лекарственные вещества), предварительно активируются за счет взаимодействия с коферментами, участвующими в межуточном обмене.
Значительная часть реакций конъюгации протекает на мембранах эндоплазматического ретикулума, непосредственно в месте образования высокореактивных метаболитов при действии монооксигеназ. Это позволяет свести до минимума при определенных условиях токсическое действие продуктов биотрансформации ксенобиотиков. Реакции конъюгации протекают и на других внутриклеточных структурах (митохондриях, лизосомах) и в цитозоле, что позволяет связывать токсические продукты, появляющиеся в клетке вне эндоплазматической сети. Характеристика наиболее важных систем конъюгации может быть представлена следующим образом:
| Типы конъюгаций | Внутриклеточная локализация реакций конъюгации | Донор макроэргов | |
| Глюкуронидная конъюгация | Эндоплазматическая сеть | УДГФК | |
| Сульфатная конъюгация | Цитозоль | ФАФС | |
| Метильная конъюгация | Цитозоль и эндоплазматическая сеть | S-аденозилметионин | |
| Глутатионовая конъюгация | Цитозоль и эндоплазматическая сеть | Ацетил-КоА | |
| Пептидная конъюгация (аминокислотная) | Митохондрии, эндоплазматическая сеть, возможно, лизосомы | КоА | |
| Ацетильные конъюгация (ацетилирование) | Цитозоль | Ацетил-КоА |
Следует подчеркнуть, что конъюгация с глюкуроновой кислотой является, по-видимому, наиболее важным механизмом конъюгации у человека и включает два основных этапа: биосинтез коферментного комплекса глюкуроновой кислоты в виде уридиндифосфатглюкуроновой кислоты и перенос с этого комплекса глюкуронидной части на инактивируемое вещество.
В качестве примера можно привести конъюгацию парааминосалициловой кислоты (ПАСК) – противотуберкулезного препарата с образованием парааминосалицилового глюкугонида.
Различают О-, S-, N-глюкурониды. Путем образования глюкуронидов обезвреживаются фенолсодержащие соединения, спирты, карбоновые кислоты, камфора, хлоралгидрат, ароматические кислоты, ариламины, дитиокарбоновые кислоты, фенилбутазон и др. Иначе говоря, глюкуронидной конъюгации подвергаются ксенобиотики, которые имеют в структуре свободные –OH, -COOH, -NH2, -SH – группы.
Образование конъюгатов в виде сложных эфиров серной кислоты (сульфатная конъюгация) происходит, в основном, в печени, являющейся одновременно основным местом синтеза коферментного комплекса фосфоаденозинфосфосульфата(ФАФС). Эта конъюгация, как и конъюгация с глюкуроновой кислотой, характерна для многих указанных выше лекарственных средств, но преимущественно подвергаются конъюгации структуры, имеющие свободные –OH и -NH2-группы. Конъюгация включает два основных этапа: образование коферментного комплекса и образование непосредственно конъюгата. В качестве примера подобной конъюгации может служить конечный этап метаболизма фенацетина с образованием эфирсульфатпараацетамидофенола.
Метилированию подвергаются ксенобиотики, в том числе лекарственные вещества, содержащие гидроксильные, сульфгидрильные и аминогруппы. Метилирование совершается в две стадии. Источником метильных групп в организме являются в основном аминокислота метионин, образующая коферментный комплекс S-аденозилметионин.
В качестве примера О-метилирования лекарства можно привести один из этапов метаболизма метилДОФА с образованием 3-О-метилметилдофамина.
При ацетильной конъюгации с помощью ацетилкоэнзима А осуществляется ацетилирование некоторых лекарственных веществ и ксенобиотиков, содержащих, преимущественно, свободные аминогруппы (ароматические и алифатические амины, сульфаниламиды, гидразины, гидразиды). Ацетилированию предшествует синтез макроэргического коферментного комплекса ацетил-КоА.
Как пример инактивации лекарственных веществ с помощью ацетил-КоА можно привести реакцию ацетилирования сульфаниламидов.
Пептидная (аминокислотная) конъюгация также является характерным путем инактивации лекарственных веществ. Конъюгация с аминокислотами, в частности, с глицином, наблюдается при метаболизме в организме ароматических и гетероциклических карбоновых кислот, которые предварительно связываются с коэнзимом А, образуя коэнзим-А-производное чужеродных карбоновых кислот, т.е. происходит активация чужеродного вещества, а не эндогенного вещества, как при других конъюгациях.
Механизм пептидной конъюгации, заключающийся в образовании коэнзим-А-производных чужеродных карбоновых кислот (первый этап) с помощью реакции с глицином (второй этап) можно проследить на примере образования гиппуровой кислоты в процессе метаболизма бензойной кислоты.
Важным типом конъюгации, протекающей с участием Ко-А, является глутатионовая конъюгация. С глутатионом могут связываться большое число разнообразных алифатических и ароматических чужеродных соединений с образованием глутатионовых конъюгатов и меркаптуровых кислот. К числу таких соединений относятся эпоксиды, альдегиды, нитриты, нитрофураны, триазоны и др.
На первом этапе ксенобиотики или их метаболиты взаимодействуют с глутатионом. Реакцию катализируют ферменты, объединенные в группу глутатион-S-трансфераз, обладающих низкой специфичностью.
На втором этапе глутатионовой конъюгации комплекс глутатион-субстрат под воздействием фермента гамма-глутамилтранмпептидазы теряет остаток глутаминовой кислоты. На третьем этапе глутатионовой конъюгации под влиянием фермента цистеинилглициндипептидазы от комплекса отщепляется остаток глицина, в результате чего конъюгат превращается в комплекс ксенобиотика с цистеином. Такой коньюгат может выводиться из организма. Однако чаще наступает четвертый, заключительный этап, заключающийся в ацетилировании под воздействием фермента ацетилтрансферазы по аминогруппе с образованием соответствующей меркаптуровой кислоты. В качестве примера глутатионовой конъюгации можно привести биотрансформацию в организме бензола, нафталина и др.
Следует подчеркнуть, что система глутатиона, наряду с глюкуронидной и сульфатной конъюгацией, составляет основу биохимических механизмов поддержания гомеостаза при действии на организм лекарственных веществ.
При рассмотрении биотрансформации лекарственных веществ следует иметь в виду, что обычно лекарства одновременно метаболизируются несколькими различными путями, образуя множество метаболитов.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 8127; Нарушение авторских прав?; Мы поможем в написании вашей работы!