
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная конфигурация и гибридизация углерода в органических соединениях
|
|
|
|
В основном состоянии атом углерода имеет следующую электронную конфигурацию:
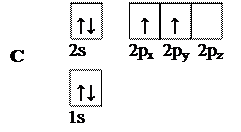 |
Рис. 3. Электронная конфигурация атома углерода в основном состоянии
Углерод в такой конфигурации не может образовывать четыре одинаковых ковалентных связи (см. лекцию 1).
Для объяснения четырехковалентности углерода в органических соединениях используют концепцию гибридизации (Л. Полинг, 1931 г.). Согласно этой концепции:
· один из электронов 2 s -орбитали переходит на свободную 2 р -орбиталь, образуя систему с четырьмя неспаренными электронами;
· 2 s - и три 2 p -орбитали смешиваются с образованием четырех эквивалентных sp3 -гибридных орбиталей.

Рис. 4. sp3 -Гибридные орбитали углерода
Используя концепцию гибридизации, построим простейшую органическую молекулу – метан. В результате перекрывания четырех гибридных sp3 -орбиталей атома углерода и s -орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана. При такой геометрии все связи эквивалентны, а молекула обладает минимальной энергией.
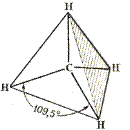
Рис. 5. Тетраэдрическая модель метана
Из рис. 5 отчетливо видно, что ковалентные связи, в отличие от ионных, обладают направленностью. Ковалентная связь образующаяся за счет перекрывания орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется s-связью (s – сигма). Она обладает круговой симметрией – при повороте связанных фрагментов относительно линии, связывающей центры атомов, энергия связи не меняется. Из s-связей построены насыщенные углеводороды и углеводородные фрагменты их функциональных производных. Длина С-Н связи 0,11 нм (1,1 Å), энергия – 417 кДж/моль (102 ккал/моль). Длина С-С связи 0,154 нм (1,54 Å), энергия – 347,5 кДж/моль (83 ккал/моль).
|
|
|
В этилене атомы углерода связаны между собой двойной связью. Углероды находятся в sp2 -гибридизованном состоянии. Две 2p - и одна 2s -орбитали смешиваются с образованием трех одинаковых sp2 -гибридных орбиталей. Формы sp2 - и sp3 -орбиталей одинаковы. В этом случае гибридные орбитали расположены в одной плоскости под углом 120о (рис. 6). Тригональное (плоскостное) расположение гибридных орбиталей наиболее энергетически выгодно. Каждый из углеродов использует две sp2 -орбитали для образования двух s-связей С-Н и одну sp2 -орбиталь для образования С-С s-связи.
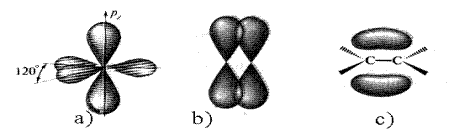
Рис. 6. sp2 -Гибридизованный углерод (a), перекрывание 2p-орбиталей (b)
и молекула этилена (с)
Не участвующая в гибридизации 2р -орбиталь расположена перпендикулярно плоскости. Боковое перекрывание негибридизованной 2р -орбитали одного углеродного атома с соответствующей орбиталью другого углерода приводит к образованию p-связи. Эта связь состоит из двух частей: одно электронное облако расположено над, другое - под плоскостью, в которой лежат атомы.
Двойная С=С связь – комбинация s- и p-связей. Длина С=С связи 0,134 нм (1,34 Å), общая энергия – 607,1 кДж/моль (145 ккал/моль). Вычитая из общей энергии известную энергию одинарной s-связи можно получить энергию p-связи:
607,1 кдж/моль - 347,5 кдж/моль = 259,6 кдж/моль (62 ккал/моль)
p-Связь имеет меньшую энергию и, следовательно, менее прочна, чем сигма.
В простейшем соединении с тройной связью – ацетилене - оба углерода находятся в sp -гибридизованном состоянии. Эквивалентные гибридные орбитали расположены на одной прямой (линейное или дигональное расположение), проходящей через ядро углерода. При образовании тройной углерод-углеродной связи гибридные орбитали образуют две s-связи. Две негибридизованные р-орбитали за счет бокового перекрывания образуют две p-связи в двух взаимно перпендикулярных плоскостях (рис. 7).
|
|
|
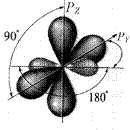
Рис. 7. sp -Гибридизованный атом углерода
Таким образом, тройная связь построена из двух p- и одной s-связи. Ее энергия - 829 кДж/моль (198 ккал/моль). Поскольку энергия С=С связи известна, энергия третьей связи может быть определена – 222 кДж/моль (43 ккал/моль). Длина тройной связи – 0,12 нм (1,2 Å).
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 717; Нарушение авторских прав?; Мы поможем в написании вашей работы!