
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні закономірності адсорбції
|
|
|
|
Адсорбція дуже поширене явище, яке використовується у хімічній, металургійній, харчовій промисловості при очищенні, розділенні і концентруванні рідинних і газових середовищ.
Адсорбція – мимовільне концентрування речовини на поверхні поділу фаз. Речовина, яка адсорбує на своїй поверхні іншу речовину носить назву адсорбента; речовина, яка адсорбується з об’єму має назву адсорбтив; ця ж речовина, яка вже адсорбувалася називається адсорбатом. Тобто для адсорбованої речовини використовують терміни адсорбтив (до адсорбції) та адсорбат (після адсорбції). Частка молекули з поверхні може перейти знову в об’єм. Процес зворотний адсорбції є десорбція.
Адсорбцію виражають у абсолютних та надлишкових величинах.
Абсолютна адсорбція 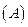 - це кількість адсорбату на одиницю поверхні адсорбенту, що дорівнює добутку концентрації адсорбату у поверхневому шарі
- це кількість адсорбату на одиницю поверхні адсорбенту, що дорівнює добутку концентрації адсорбату у поверхневому шарі  і товщині цього шару
і товщині цього шару  :
:
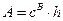 .
.
Надлишок адсорбату у поверхневому шарі порівняно з його кількістю в об’ємної фазі характеризує надлишкову чи гіббсовську адсорбцію, яка показує на скільки збільшилася концентрація адсорбата внаслідок адсорбції
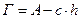 ,
,
де  - рівноважна концентрація адсорбата в об’ємі.
- рівноважна концентрація адсорбата в об’ємі.
Якщо 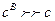 , то
, то 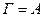 .
.
Адсорбція відноситься до поверхневих явищ і проходить мимовільно. Концентрування речовини на поверхні поділу фаз відбувається до досягнення рівноваги між процесами адсорбції та десорбції, тобто до досягнення 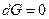 . Практично це відповідає рівності хімічних потенціалів адсорбенту і адсорбтиву. Таким чином, адсорбцію можна визначити як процес вирівнювання хімічного потенціалу, який призводить до змінення концентрації компонентів на межі поділу фаз порівняно з їх концентрацією в об’ємі. У випадку адсорбції одного компонента
. Практично це відповідає рівності хімічних потенціалів адсорбенту і адсорбтиву. Таким чином, адсорбцію можна визначити як процес вирівнювання хімічного потенціалу, який призводить до змінення концентрації компонентів на межі поділу фаз порівняно з їх концентрацією в об’ємі. У випадку адсорбції одного компонента
|
|
|
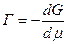 ,
,
це рівняння називають фундаментальним рівнянням адсорбції Гіббса.
Залежність між адсорбцією, концентрацією ПАР та зміною поверхневого натягу виражається рівнянням Гіббса, 
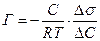 ,
,
де  - зміна поверхневого натягу, яка відповідає зміні концентрації
- зміна поверхневого натягу, яка відповідає зміні концентрації 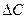 ;
;
 - поверхнева активність;
- поверхнева активність;
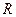 - універсальна газова стала;
- універсальна газова стала; 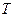 - температура.
- температура.
Залежно від природи адсорбційних сил розрізняють фізичну та хімічну адсорбції.
При фізичній адсорбції взаємодія адсорбенту та адсорбату здійснюється за рахунок сил Ван-дер-Ваальса та водневих зв’язків. Молекули адсорбату зберігають свої індивідуальні властивості. Фізична адсорбція зворотня, малоспецифічна, нелокалізована і зменшується зі збільшенням температури.
При хімічній адсорбції (хемосорбції) молекули адсорбату утворюють з адсорбентом поверхневі хімічні сполуки. Хемосорбція незворотня, специфічна та локалізована.
Теоретично адсорбція на сучасному рівні розроблена Брунауером, Емметом, Теллером (теорія БЕТ). Вона враховує наявність активних центрів адсорбції і можливість утворення декількох шарів адсорбату.
Залежно від агрегатного стану адсорбенту і адсорбтиву розрізняють адсорбцію на межі твердого тіла та газу (Т-Г); рідини і газу (Р-Г); рідини і ПАР (Р-Р); твердого тіла і рідини (Т-Р).
Адсорбція на межі рідина – газ (Р-Г)
На межі поділу рідина-газ (вода-повітря) можуть мимовільно адсорбуватися молекули поверхнево-актиних речовин (ПАР), що формують межеві адсорбційні шари, які радикально змінюють властивості поверхні поділу фаз та дисперсних систем.
Речовини, які зменшують поверхневий натяг чистих розчинників і концентруються на поверхні поділу фаз, мають назву поверхнево-активних речовин (ПАР). До них належать органічні кислоти  , спирти
, спирти 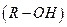 , аміни
, аміни 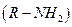 , сульфопохідні
, сульфопохідні 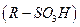 , синтетичні миючі засоби, мила, білки тощо.
, синтетичні миючі засоби, мила, білки тощо.
Молекула ПАР дифільна і має полярну та неполярну частини. Полярна частина гідрофільна і сприяє розчиненню ПАР у воді, а неполярна частина гідрофобна і сприяє розчиненню ПАР у неполярних розчинниках. При розчиненні ПАР у воді поверхневий натяг зменшується (поверхневий натяг 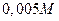 розчину стеарату натрію приблизно
розчину стеарату натрію приблизно  ). При додаванні ПАР у рідину взаємодія їх з диполем води (розчинника) слабкіша, ніж взаємодія між молекулами води, і молекули ПАР виштовхуються в поверхневий шар, де концентруються. Підвищення концентрації ПАР приводить до зниження поверхневого натягу, що можна виразити ізотермою поверхневого натягу (рис. 1.3 а).
). При додаванні ПАР у рідину взаємодія їх з диполем води (розчинника) слабкіша, ніж взаємодія між молекулами води, і молекули ПАР виштовхуються в поверхневий шар, де концентруються. Підвищення концентрації ПАР приводить до зниження поверхневого натягу, що можна виразити ізотермою поверхневого натягу (рис. 1.3 а).
|
|
|
Здатність речовини при адсорбції на межі поділу фаз знижувати поверхневий натяг залежно від його концентрації в об’ємі називають поверхневою активністю 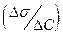 . Для ПАР
. Для ПАР 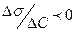 , а адсорбція більше нуля (позитивна) (рис. 1.3 б).
, а адсорбція більше нуля (позитивна) (рис. 1.3 б).
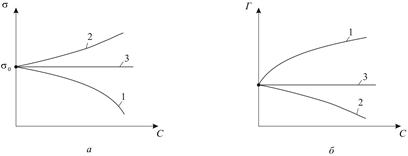
Рисунок 1.3 – Ізотерми поверхневого натягу (а) і адсорбції (б):
1 – для поверхнево-активних речовин; 2 – для поверхнево-інактивних речовин; 3 – для речовин, які не впливають на поверхневий натяг;
 - поверхневий натяг чистого розчинника.
- поверхневий натяг чистого розчинника.
Поверхнева активність ПАР одного гемологічного ряду збільшується в 3 – 3,5 раза при збільшенні вуглеводневого радикала на одну  групу (правило Дюкло-Траубе). Дія правила обмежена кількістю атомів Карбону у молекулі
групу (правило Дюкло-Траубе). Дія правила обмежена кількістю атомів Карбону у молекулі 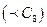 . Збільшення кількості атомів Карбону приводить до зменшення поверхневого натягу, але не в такій залежності.
. Збільшення кількості атомів Карбону приводить до зменшення поверхневого натягу, але не в такій залежності.
Зниження поверхневого натягу внаслідок адсорбції ПАР на межі поділу рідина-газ визначають за рівнянням Шишьковського
 ,
,
де 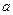 ,
, 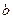 - емпірічні коефіцієнти.
- емпірічні коефіцієнти.
Зниження поверхневого натягу внаслідок адсорбції можна визначити за рівнянням Фрумкіна
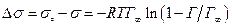 .
.
Залежність між адсорбцією, концентрацією ПАР та зміною поверхневого натягу виражає фундаментальне рівняння Гіббса, 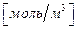
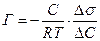 .
.
Виходячи з експериментальних даних, на основі рівняння Гіббса будують ізотерму адсорбції  (рис. 1.4).
(рис. 1.4).
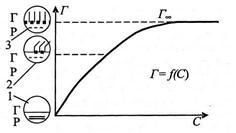
Рисунок 1.4 – Ізотерма адсорбції поверхнево-активної речовини:
1 – чистий розчинник; 2 – ненасичений мономолекулярний шар ПАР;
3 – насичений мономолекулярний шар ПАР
Внаслідок дифільної будови молекули ПАР адсорбуються на межі поділу фаз вода-повітря, при цьому орієнтуються певним чином. Гідрофільна частина молекули (позначена кружком) має спорідненість з полярними молекулами води і взаємодіє з нею, а неполярна гідрофобна частина (позначена паличкою) виштовхується у неполярну фазу (повітря). При деякій концентрації розчину ПАР встановлюється гранична адсорбція і на поверхні води утворюється моношар, тобто один ряд адсорбованих молекул.
|
|
|
Гранична адсорбція – це адсорбція у момент утворення моношару адсорбату, складеного із молекул ПАР. У цей час адсорбція зростає і залишається постійною, оскільки поверхневий шар повністю заповнений (процес динамічний). Доведено, що 1 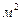 площі адсорбційного моношару вміщує одну і ту саму мінімальну кількість ПАР одного гомологічного ряду, тому можна розрахувати площину однієї молекули, яку вона займає у моношарі
площі адсорбційного моношару вміщує одну і ту саму мінімальну кількість ПАР одного гомологічного ряду, тому можна розрахувати площину однієї молекули, яку вона займає у моношарі
 ,
,
де  - число Авагадро, яке дорівнює
- число Авагадро, яке дорівнює 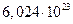 .
.
Товщина моношару залежить від довжини неполярної гідрофобної частини. Товщину моношару визначають за формулою
 ,
,
де  - молекулярна маса ПАР;
- молекулярна маса ПАР;  - густина.
- густина.
Граничну адсорбцію, використовуючи рівняння Ленгмюра, визначають експериментально-графічним методом (рис. 1.5)
 , чи
, чи
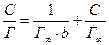

Рисунок 1.5 – Графічне визначення 
У координатах «С/Г − С» рівняння Ленгмюра описується прямою. Тангенс кута цієї прямої є величина обернена гранічній адсорбції, відрізок який відсікається на осі ординат характеризує величину  . Далі знаходять чисельне значення b, яке характеризує сталу рівноваги процесів адсорбції і десорбції і пов’язана з поверхневою активністю.
. Далі знаходять чисельне значення b, яке характеризує сталу рівноваги процесів адсорбції і десорбції і пов’язана з поверхневою активністю.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1440; Нарушение авторских прав?; Мы поможем в написании вашей работы!