
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стійкість дисперсних систем
|
|
|
|
Проблема стійкості є центральною проблемою колоїдної хімії, бо це проблема «життя та смерті» дисперсної системи.
Практично існують дві задачі: зберегти дисперсну систему чи її зруйнувати. Стійкість визначає здатність дисперсних систем зберігати свій склад незмінним, тобто залишати концентрацію дисперсної фази і розподіл частинок за розмірами постійними у часі.
Істинні розчини, на відміну від колоїдних розчинів, стійкі. Стійкість означає здатність колоїдного розчину зберігати свій ступінь дисперсності. Колоїдні системи характеризються різними ступенями стійкості. Розрізняють седиментаційну (кінетичну), агрегативну та термодинамічну стійкості колоїдних розчинів.
Седиментаційна стійкість визначається здатністю зберігати однорідне розподілення частинок по всьому об’єму системи, тобто протистояти їх осадженню. Для колоїдних розчинів, як і істинних, характерний броунівський рух, який супроводжується дифузним вирівнюванням концентрації частинок у всьому об’ємі. Звичайно, броунівський рух залежить від розмірів частинок, температури, в’язкості дисперсійного середовища. Високодисперсні системи, у тому числі колоїдні розчини ВМС кінетично (седиментаційно) стійкі. Грубодисперсні системи (емульсії, суспензії) кінетично нестійкі, внаслідок чого спостерігається явище осідання частинок і утворення двох фаз. Седиментаційна рівновага порушується, якщо розмір частинок перевищує 100 нм (0,1 мкм) і при цьому частинки осідають. Можна визначити радіус частинок за формулою
 ,
,
де 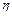 - в’язкість дисперсійного середовища;
- в’язкість дисперсійного середовища; 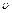 - швидкість осідання частинок;
- швидкість осідання частинок;  ,
,  - густина дисперсної фази і дисперсійного середовища відповідно;
- густина дисперсної фази і дисперсійного середовища відповідно;  - прискорення вільного падіння.
- прискорення вільного падіння.
|
|
|
Термодинамічно стійкі системи утворюються внаслідок мимовільного розчинення однієї з фаз і супроводжуються мимовільним зменшенням вільної поверхневої енергії 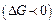 . Дисперсні системи, утворення яких відповідає зменшенню вільної поверхневої енергії, є ліофільними, при цьому відбувається збільшення ентропії. Типовими термодинамічними системами є мікроемульсії, колоїдні ПАР, бентонітові глини, розчини ВМС та інші. Термодинамічна стійкість визначає стійкість концентрації та розмірів частинок.
. Дисперсні системи, утворення яких відповідає зменшенню вільної поверхневої енергії, є ліофільними, при цьому відбувається збільшення ентропії. Типовими термодинамічними системами є мікроемульсії, колоїдні ПАР, бентонітові глини, розчини ВМС та інші. Термодинамічна стійкість визначає стійкість концентрації та розмірів частинок.
Більшість дисперсних систем термодинамічно нестійкі (ліофобні). Нестійкість ліофобних систем пов’язана з надлишком поверхневої енергії 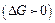 . Міжмолекулярна взаємодія між дисперсною фазою і дисперсійним середовищем досить значна. Характерними термодинамічно нестійкими системами є золі металів. Для збільшення їх стійкості додають стабілізатори.
. Міжмолекулярна взаємодія між дисперсною фазою і дисперсійним середовищем досить значна. Характерними термодинамічно нестійкими системами є золі металів. Для збільшення їх стійкості додають стабілізатори.
Агрегативна стійкість – це здатність частинок дисперсної фази зберігати ступінь дисперсності незмінним. Вона пов’язана з надлишком вільної поверхневої енергії, яка визначається некомпенсованістю молекулярної взаємодії на межі поділу фаз. При відносно великих відстанях між частинками, поверхневі сили діють відокремлено і в дисперсійній системі є тиск  . При зближенні частинок утворюється тонкий шар між ними (
. При зближенні частинок утворюється тонкий шар між ними (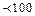 мкм), тобто відбувається перекривання двох суміжних фазових ділянок і у шарі рідини виникає додатковий тиск
мкм), тобто відбувається перекривання двох суміжних фазових ділянок і у шарі рідини виникає додатковий тиск 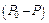 порівняно з тиском об’ємної фази (розклинювальний тиск, Б.В. Дерягін). Це другий фактор, який визначає агрегативну стійкість дисперсних систем. Агрегативно стійкі (ліофобні) дисперсні системи не утворюють агрегатів і не злипаються при зіткненні частинок дисперсної фази. При порушенні агрегативної стійкості утворюються агрегати, які в подальшому випадають в осад.
порівняно з тиском об’ємної фази (розклинювальний тиск, Б.В. Дерягін). Це другий фактор, який визначає агрегативну стійкість дисперсних систем. Агрегативно стійкі (ліофобні) дисперсні системи не утворюють агрегатів і не злипаються при зіткненні частинок дисперсної фази. При порушенні агрегативної стійкості утворюються агрегати, які в подальшому випадають в осад.
Ліофобні золі складаються з міцел та інтерміцелярної рідини, в якій, крім розчинника, є електроліти, ПАР та інші домішки.
|
|
|
Розглянемо частинку дисперсної фази золю  у розведеному розчині
у розведеному розчині  .
.
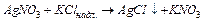
Згідно з наведеним рівнянням у розчині тільки  буде знаходитись у твердому стані і зможе утворювати колоїдні частинки. Якщо вихідні речовини взяті в еквівалентних кількостях або концентрація їх велика, то швидко відбувається кристалізація з випаданням осаду. Якщо одна з речовин у розведених розчинах буде у надлишку, то при досягненні деяких розмірів кристалу відбувається процес адсорбції на поверхні йонів, які є у розчині.
буде знаходитись у твердому стані і зможе утворювати колоїдні частинки. Якщо вихідні речовини взяті в еквівалентних кількостях або концентрація їх велика, то швидко відбувається кристалізація з випаданням осаду. Якщо одна з речовин у розведених розчинах буде у надлишку, то при досягненні деяких розмірів кристалу відбувається процес адсорбції на поверхні йонів, які є у розчині.
Згідно з правилом Ліпатова на ядрі  адсорбуються ті йони, які мають спільну хімічну природу з речовиною у ядрі, тобто будуть адсорбуватися йони хлору (потенціалзумовлюючі) і поверхня ядра заряджатиметься негативно. Цей заряд визначає величину електротермодинамічного потенціалу
адсорбуються ті йони, які мають спільну хімічну природу з речовиною у ядрі, тобто будуть адсорбуватися йони хлору (потенціалзумовлюючі) і поверхня ядра заряджатиметься негативно. Цей заряд визначає величину електротермодинамічного потенціалу 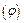 , який приблизно дорівнює 1 В. Потенціалзумовлюючі йони разом з протиіонами утворюють адсорбційний шар. Далі заряджене ядро притягує до себе йони калію (протиіони), але в кількості, недостатній для повної нейтралізації заряду з утворенням гранули, яка має заряд, у нашому випадку - негативний. Заряд гранули збігається за знаком із потенціалзумовлюючими йонами. Заряд гранули називають електрокінетичним, або
, який приблизно дорівнює 1 В. Потенціалзумовлюючі йони разом з протиіонами утворюють адсорбційний шар. Далі заряджене ядро притягує до себе йони калію (протиіони), але в кількості, недостатній для повної нейтралізації заряду з утворенням гранули, яка має заряд, у нашому випадку - негативний. Заряд гранули збігається за знаком із потенціалзумовлюючими йонами. Заряд гранули називають електрокінетичним, або  -потенціалом, знак і величина якого визначають напрямок руху колоїдної частинки в електричному полі, а також її швидкість. Відсутні йони калію до повної електронейтральності утвореної частинки розміщені у дифузійному шарі і утворюють міцелу. Частинка дисперсної фази разом із зарядами, які утворюють подвійний електричний шар, називається міцелою. Вона електронейтральна. Таким чином, формула міцели буде мати таку будову:
-потенціалом, знак і величина якого визначають напрямок руху колоїдної частинки в електричному полі, а також її швидкість. Відсутні йони калію до повної електронейтральності утвореної частинки розміщені у дифузійному шарі і утворюють міцелу. Частинка дисперсної фази разом із зарядами, які утворюють подвійний електричний шар, називається міцелою. Вона електронейтральна. Таким чином, формула міцели буде мати таку будову:
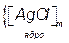
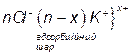
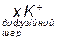

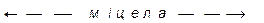
Звичайно  .
.
Методи одержання колоїдних розчинів. Колоїдні розчини одержують двома основними методами:
- конденсаційний метод, який приводить до збільшення розмірів частинок істинних розчинів при агрегації;
- метод диспергування, який відбувається за рахунок подрібнення великих частинок до колоїдного ступеня дисперсності.
Диспергування проводять у дробарках, млинах, жорнах, шарових чи колоїдних млинах, ультразвуком та ін., при цьому відбувається збільшення міжфазової поверхні за рахунок надходження енергії ззовні. Для перетворення новоутвореного осаду в колоїдний стан застосовують пептизатори.
|
|
|
Конденсація може бути як фізичною, так і хімічною. При хімічній конденсації нова фаза виникає під час перебігу реакцій − окиснення, відновлення, подвійного обміну, у тому числі гідроліз солей.
Найбільш поширені реакції подвійного обміну внаслідок їх одержують більшість золей. Як стабілізатор золю виступає надлишок одного із реагентів:
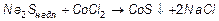

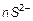

 .
.
Реакція гідролізу відбувається у промислових стоках, де є йони важких металів. У надлишку при гідролізі є соль металу, а не вода. При підвищенні температури та збільшенні розведення ступінь гідролізу збільшується. Явище утворення колоїдного золю цим методом може спостерігатися при неправильно приготованих лікарських розчинах, які вміщують йони, здатні до утворення золю. Так, золь гідроксиду алюмінію (ПІ) одержується за схемою

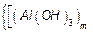


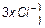 .
.
Реакції окиснення для одержання золів широко поширені у повітрі з огляду вмісту в ньому сульфурвмісних сполук, які окиснюються до вільного сульфуру (тверда речовина).
Реакції відновлення при утворенні золів характерні для благородних металів (платина, золото, срібло). Для стабілізації цих золів застосовують ВМС.
У повітрі відбувається досить реакцій, пов’язаних з окисненням сульфурвмісних сполук, наприклад
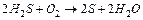 ,
,
крім того утворюються політіонові кислоти  , які є стабілізаторами золю сульфура, що призводить до утворення міцели такої будови
, які є стабілізаторами золю сульфура, що призводить до утворення міцели такої будови
 .
.
Одержані колоїдні розчини мають домішки, які впливають на їх властивості. Домішки можна видалити різними методами: діаліз і ультрафільтрацією.
Діаліз. При діалізі систему (розчин ВМС, золю) відокремлюють напівпроникною мембраною (пергамент, целофан) від дисперсійного середовища (води).

Рисунок 2.2 - Схема діалізу (а); електродіалізу (б)
1 - електроди; 2 - мембрани
Макромолекули ВМС залишаються у системі, а молекули та йони низькомолекулярних сполук дифундують через мембрану у розчинник (рис. 2.2). Якщо періодично змінювати зовнішній розчин, то очищення можна прискорити.
|
|
|
Інтенсифікувати очищення колоїдного розчину за допомогою діалізу можна шляхом прикладання зовнішнього тиску  . У цьому випадку процес називається ультрафільтрацією. Цей метод використовують для лікування хворих з ендогенними інтоксикаціями, гострою печінково-нирковою недостатністю.
. У цьому випадку процес називається ультрафільтрацією. Цей метод використовують для лікування хворих з ендогенними інтоксикаціями, гострою печінково-нирковою недостатністю.
Для інтенсифікації процесу очищення за допомогою мембран застосовують електродіаліз (рис. 2.2 б). Електродіаліз − це прискорений процес діалізу для видалення електролітів під дією зовнішнього джерела постійного струму. Колоїдний розчин золю (золь ВМС) розміщують між двома напівпроникними перетинками, які пропускають йони дисперсійного середовища селективно. У корпус вмонтовані електроди. Термін очищення скорочується до декількох хвилин. Спільною дією електричного поля і зовнішнього тиску забезпечується повне винищення домішок з рідини.
Деякі важливі функції нирок людини (виділення відпрацьованих продуктів із крові, регулювання кров'яного тиску, а також водневого та електричного балансу) достатньо повно проводить "штучна нирка", яка працює за принципом компенсаційного діалізу. Очищення крові цим методом є гемодіаліз. Кров пропускається під тиском крізь тонкі щілини між мембранами, які омиваються фізіологічним розчином. Завдяки великій площині мембран (до 1,5 м2) кров за 3-4 години повністю очищується від "шлаків" - продуктів обміну і розкладання тканин (сечовини, сечової кислоти, токсинів тощо).
Коагуляція це процес об'єднання колоїдних частинок у більш крупні агрегати. Коагуляція може бути зумовлена зовнішніми факторами (введенням електролітів, неелектролітів, заморожуванням, кип'ятінням, підвищенням температури), механічним перемішуванням, впливом іонізуючих випромінювань.
Існують два типи коагуляції:
- нейтралізаційна (адсорбційна) коагуляція спостерігається для золей та емульсій, які мають слабкий електричний заряд і невеликий потенціал (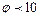 мВ), причому значення
мВ), причому значення  - потенціалу не набагато відрізняються від значення
- потенціалу не набагато відрізняються від значення  -потенціалу. Нейтралізаційну коагуляцію викликають електроліти, які мають йони, здатні до специфічної адсорбції. Відбувається нейтралізація надлишкових зарядів потенціалутворюючого шару і знижується
-потенціалу. Нейтралізаційну коагуляцію викликають електроліти, які мають йони, здатні до специфічної адсорбції. Відбувається нейтралізація надлишкових зарядів потенціалутворюючого шару і знижується  -потенціал, що призводить до послаблення електростатичного відштовхування і сприяє злипанню частинок при їх зближенні;
-потенціал, що призводить до послаблення електростатичного відштовхування і сприяє злипанню частинок при їх зближенні;
- концентраційна коагуляція характерна для золів, які мають досить значний електричний заряд, їх потенціал досягає значення більше 100 мВ. Різниця між  -потенціалом і
-потенціалом і  -понтеціалом значна. При концентраційній коагуляції втрата стійкості зумовлена стиском дифузійної частини ПЕШ при незмінному
-понтеціалом значна. При концентраційній коагуляції втрата стійкості зумовлена стиском дифузійної частини ПЕШ при незмінному  -потенціалі. Вона відбувається під дією індиферентних електролітів, які нездатні до специфічної адсорбції: відбувається стиск дифузного шару за рахунок придушення дифузії і переміщення йонів з дифузного в адсорбційний шар, внаслідок чого знижується
-потенціалі. Вона відбувається під дією індиферентних електролітів, які нездатні до специфічної адсорбції: відбувається стиск дифузного шару за рахунок придушення дифузії і переміщення йонів з дифузного в адсорбційний шар, внаслідок чого знижується  -потенціал. Це дозволяє частинкам наблизитися на близьку відстань і за рахунок міжмолекулярної взаємодії відбувається злипання частинок (коагуляція).
-потенціал. Це дозволяє частинкам наблизитися на близьку відстань і за рахунок міжмолекулярної взаємодії відбувається злипання частинок (коагуляція).
Процес коагуляції виявився чутливим при додаванні електролітів (неорганічні солі). Коагуляція залежить від природи і концентрації електролітів. Зміна концентрації електролітів впливає на швидкість коагуляції (рис. 2.3)

Рисунок 2.3 - Зміна швидкості коагуляції залежно від концентрації електроліту: І - ділянка, де відсутня коагуляція;
II - ділянка з прихованою коагуляцією; III - ділянка з повільною коагуляцією; IV - ділянка з постійною швидкістю коагуляції.
На ділянці І (рис. 2.3) коагуляція відсутня, при цьому електростатичне відштовхування більше, ніж міжмолекулярна взаємодія. При деякій концентрації електроліту починається злипання частинок і спостерігається так звана прихована коагуляція (візуально непомітно), яка є повільною (ділянка II, рис. 2.3). Повільна коагуляція - це коагуляція, при якій не всі частинки, які зустрічаються злипаються. Мінімальна концентрація електроліту, що зумовлює видиму коагуляцію золю, називається порогом коагуляції  . Поріг коагуляції визначають за формулою
. Поріг коагуляції визначають за формулою
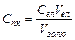
Формула відповідає дійсності, якщо  . У разі коли
. У разі коли 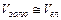 , то у знаменнику враховувають загальний об'єм, але на практиці електроліти, які потрібно додавати у таких великих об'ємах, не застосовують.
, то у знаменнику враховувають загальний об'єм, але на практиці електроліти, які потрібно додавати у таких великих об'ємах, не застосовують.
Це відповідає ділянці ІІІ (рие. 2.3). Величина, обернена порогу коагуляції, називається коагулюючою здатністю електроліту 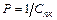 . Потім відбувається перехід повільної коагуляції у швидку (ділянка IV, рис. 2.3), при цьому швидкість коагуляції буде постійною і відбуватиметься злипання усіх частинок, які зустрічаються. Теорію швидкої коагуляції розробив М.Смолуховський.
. Потім відбувається перехід повільної коагуляції у швидку (ділянка IV, рис. 2.3), при цьому швидкість коагуляції буде постійною і відбуватиметься злипання усіх частинок, які зустрічаються. Теорію швидкої коагуляції розробив М.Смолуховський.
Коагуляція під впливом електролітів підпорядковується емпіричним правилам, які виконуються за деяких умов. Перше правило Шульце-Гарді формулюється так: чим вищий заряд коагулюючого йона, тим менше його потрібно для коагуляції. Згідно з теорією ДЛФО поріг коагуляції обернений шостому ступеню валентності 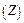 :
:
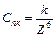 ,
,
де 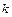 - коефіцієнт, який характеризує дисперсну фазу, дисперсійне середовище і структуру подвійного електричного шару.
- коефіцієнт, який характеризує дисперсну фазу, дисперсійне середовище і структуру подвійного електричного шару.
Для однієї і тієї системи співвідношення порогів коагуляції для одно-, дво- та тривалентних йонів буде

Друге правило Шульце-Гарді − для йонів однакової валентності поріг коагуляції тим нижчий, чим більший порядковий номер цього йона. Коагулююча здатність електроліту визначається положенням йона в ліотропному ряді.
Згідно з правилом коагулювальну дію, звичайно, виявляє йон, заряд якого за знаком протилежний заряду поверхні колоїдних частинок. Коагулювальна дія органічних йонів (поверхнево-активних сполук − алкалоїди, нуклеїнові кислоти і т.д.) значно вище, ніж неорганічних йонів. З найбільшою швидкістю коагулюють електронейтральні частинки ліофобних золів.
Залежно від швидкості додавання коагулянта, може відбуватися (швидке додавання) або не відбуватися коагуляція (повільне додавання). Спостерігається явище звикання золю, внаслідок утворення пептизатора. Це явище характерне для живих організмів. Організм звикає до отрути, наприклад, нікотину.
При коагуляції сумішами електролітів може відбуватися послаблення коагуляції (антагонізм), посилення коагуляції (синергізм) і не спостерігатися змін (адитивність).
Значно поширене явище взаємної коагуляції. Це явище використовують для очищення питної води та стічних вод. Колоїдний розчин води (містить негативно заряджені частинки грунту, органічні домішки, мікрофлору) при додаванні позитивно заряджених золів гідроксиду алюмінію або гідроксиду феруму підлягає взаємній коагуляції з випадінням частинок, які відфільтровують на звичайних піщаних фільтрах. Взаємна коагуляція відбувається при додаванні до золю з негативно зарядженими' гранулами до золю з позитивно зарядженими гранулами.
Для колоїдних систем характерне старіння, яке відбувається повільно і мимовільно і приводить до утворення двох фаз (синерезис).
Збільшення стійкості колоїдної системи відбувається під дією поверхнево-активних речовин, високомолекулярних сполук. В основі захисної дії лежить адсорбція молекул захисної речовини поверхнею колоїдних частинок, що заважає їх злипанню, тобто агрегації (рис.2.4 а).
Якщо захисні речовини будуть знаходитися у колоїдному розчині в недостатній кількості (рис.2.4 б), то на них можуть адсорбуватися колоїдні частинки, утворюючи крупний агрегат, який має низьку стійкість (астабілізація).
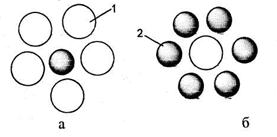
Рисунок 2.4 - Явище "захисту" (а) і астабілізації (б) колоїдної частинки;
1-поверхнево-активна речовина; 2 – золь
«Захистом» колоїдного розчину називають стабілізацію золів стосовно електролітів шляхом додавання невеликої кількості ВМС чи ПАР, які мають назву захисних. До захисних речовин відносять мила, синтетичні мийні засоби, ефіри целюлози, білки, декстрин, крохмаль тощо. Захисну здатність речовин порівнюють згідно із стандартним золем (наприклад, золь золота).
Під золотим числом розуміють число міліграм високомолекулярної сполуки, яке необхідно додати до 10 см3 червоного золю золота для того, щоб не відбулося посиніння його при введені у систему 1 см3 10% розчину хлориду натрію. Для желатину воно становить 0,01; декстрину – 20; крохмалю – 20.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2283; Нарушение авторских прав?; Мы поможем в написании вашей работы!