
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для специалистов образования
|
|
|
|
ЛЕКЦИЯ
Кам'яне різьблення прикрашало зовнішні стіни соборів. Воно складалося з рослинного та зооморфного орнаменту, зображень казкових чудовиськ, екзотичних тварин, звірів і птахів, що сплітаються шиями або хвостами - мотив запозичений зі Сходу. Інколи вони містили експресивні фігури людей. Статуї на фризах - приземкуваті, а на стовпах та колонах мають видовжені пропорції. В них помітна важкуватість і масивність, порушення пропорцій людського тіла.
Проверка рангового коэффициента корреляции на достоверность.
Ранговый коэффициент корреляции.
Построение линий регрессии.
Проверка параметрического коэффициента корреляции на достоверность.
Параметрический коэффициент корреляции.
Для романського стилю характерна відсутність програми у розміщенні декоративних мотивів - геометричних, "звіриних", біблійних. Одні пояснюють це нестабільністю світоглядної картини, двовір'ям середньовічної доби, інші вважають, що вся фантасмагорична фауна - кентаври, сфінкси, грифони, леви і гарпії не несуть жодного символічного навантаження і мають переважно декоративний характер. Інтер'єр романського храму слабо освітлений. Крім скульптур, він прикрашався мозаїкою та фресками, що не дійшли до нашого часу, за винятком оригінальних за стилем і дивовижних за експресією каталонських фресок, які згодом надихали Ель Греко та молодого П. Пікассо.
Взірцями храмової романської архітектури вважаються собор Нотр-Дам ла Гранд у Пуатьє, собори в Тулузі, Орсивалі, Велезі, Арлі (Франція), Вормсі, Майнці, Шпайєрі (Німеччина), Оксфорді, Вінчестері, Норичі (Великобританія) та в інших європейських країнах. В Україні романськими рисами особливо позначена архітектура та розписи Круглої церкви с.Горяни поблизу Ужгорода. У кінці XIX ст., коли в архітектурі запанувала еклектика, елементи романського стилю використані в деяких спорудах м. Чернівці (Центральні корпуси Чернівецького державного університету).
|
|
|
Було б неправильно розглядати романське мистецтво як суто західний стиль. Знавці бачили у ньому сильні азійські, в тому числі візантійські й перські, впливи. Однак головну роль у формуванні середньовічного мистецтва відіграли спільні греко-кельтські витоки, норманнські, слов'янські елементи. У романському мистецтві через його неоднорідність виділяли також безліч регіональних шкіл, наприклад, ломбардську, саксонську, тосканську.
У ХIII-ХV ст. культуру Європи значною мірою формує готика (від франц. gotique – назва германського племені готів). Цей термін виник в Італії в епоху Відродження, коли склалося уявлення, що стрільчаста арка середньовічної архітектури походить від форми гостроверхого шатра готських племен, які начебто будували його, зв'язуючи крони дерев.
Новий стиль небезпідставно називають “французькою манерою”, або “французьким мистецтвом”, у зв'язку з тим, що він започаткувався в 40-х роках XII ст. у північно-східній частині Франції. Початок готики пов'язаний з перебудовою церкви абатства Сен-Дені за ініціативою абата Сюжера (1088-1151). Запрошені ним з “усіх частин королівства” митці та будівельники започаткували селективний процес, який привів до синтезу всіх французьких регіональних стилів, наслідком чого стала поява готики.
Факт народження готики вважається кульмінацією романського мистецтва. Цей фантастично вишуканий стиль чотири століття панував у Європі від Північного до Середземного моря, виявившись в архітектурі, скульптурі, меблях та одязі. При всіх національних особливостях готики, їй, на відміну від попереднього романського мистецтва, притаманна стилістична єдність. Готика є мистецьким виразом духовної, а саме - релігійної згуртованості народів середньовічної Європи, незважаючи на політичну боротьбу між ними та економічне протистояння. Вона концентровано виражає загальний дух Середньовіччя при всій різноманітності племінних, етнічних та регіональних особливостей, притаманних тодішній Європі. Недарма її пізній різновид зветься стилем інтернаціональної готики.
|
|
|
Особливістю готичної будови є стрільчаста арка, що відіграє не тільки декоративну, а й принципово значиму конструктивну роль. Вона полегшує кам'яні склепіння романських будов. Система арок, аркбутанів та контрфорсів творили каркасну систему, у якій стіна як конструктивна частина будівлі ставала ніби зайвою, вона перетворюється на простінки з великими вікнами. Новий підхід давав можливість будувати споруди небаченої раніше висоти, перекривати широкі прольоти.
Каркасна система готичної архітектури дозволяла створювати високі та об'ємні інтер'єри соборів і робити величезні вікна з багатокольоровими вітражами. Спрямованість собору вгору підкреслювалася гігантськими “ мережаними” баштами, високими стрільчастими арками, вікнами і порталами (від лат. porta – двері, ворота; архітектурно виділений на фасаді вхід у будівлю), численними декоративними деталями.
Заміна глухих стін величезними вікнами привела до того, що розпис стін, характерний для романських соборів, поступається місцем скульптурі та вітражу. Вітраж - своєрідний вид живопису, в якому зображення складається з різнокольорового, з'єднаного вузькими смугами зі свинцю та охопленого залізною арматурою скла. Вітражі, розміщені у віконних прорізах, були такими важкими, що трималися в гнізді без закріплення. Найефектніші вітражі у Сент-Шапелі, Шартрі (Франція).
Взірцями готики є собори у Франції (собор Нотр-Дам у Парижі, собори у Реймсі та Ам'єні), у Німеччині (собору Кельні), Голландії, Італії, Іспанії, Чехії (собор св. Віта у Празі), Великобританії (Вестмінстерське абатство в Лондоні), Польщі (костьоли Діви Марії у Гданську та Кракові), в Австрії (собор св. Стефана у Відні); чудові взірці готики є у Талліні, Ризі, Вільнюсі.
Загальновизнаним внеском середньовічного мистецтва у світову культуру вважається мистецтво театру. Ще наприкінці раннього Середньовіччя на площах та вулицях міст відбувалися вистави мандрівних акторів - фокусників і акробатів, танцюристів і музикантів тощо. У цих виставах буяв веселий дух ярмарку, розкутого жарту.
|
|
|
У ХIII-ХIV ст. з'являється новий жанр середньовічної театральної вистави - міракль, драматична інтерпретація біблійних легенд про святих та Діву Марію. Вершиною середньовічного театру є містерія (від лат. mysterium – таємниця). Розквіт цього жанру припадає на пізнє Середньовіччя - приблизно XV ст. У містеріях брало участь майже все населення міста: одні - як актори (до 300 чоловік і більше), інші - як глядачі. Виставу приурочували до ярмарків, урочистих подій. Сюжети бралися з Біблії та Євангелія. Дійство тривало з ранку до вечора впродовж кількох днів. Містерія, як зразок майданного дійства, зверненого до великої аудиторії, виражала й народні, земні цінності, і систему релігійних поглядів. Ця внутрішня суперечливість жанру незабаром призвела до його занепаду, а пізніше - й до заборони церквою.
Іншим популярним видом театрального дійства були мораліте (від франц. moralite - моральність) - самостійні п'єси повчального характеру. Грали мораліте на відкритому просторі. На горішньому ярусі сцени розташовувалися небесні сфери, населені янголами. Алегоричні фігури, поділені на два табори, з'являлися з протилежних боків. Загальним знаменником мораліте є ідея про те, що страждання та стриманість винагороджуються на небі, а жорстокість та жадібність ведуть до пекла. Отже, у виставах майданного театру відобразилися життєлюбність середньовічної людини, її весела зухвалість і жадоба дива віра в перемогу добра та справедливості.
Середньовіччя стало епохою розвитку численних ремесел та появи важливих винаходів. Так, з XI ст. у будівельний вжиток увійшли обпалена цегла, кахлі, черепиця. З XII ст. у Європі було освоєно нові технології оброблення металів: зварювання, термічне оброблення, кування, штампування, витягування, згинання, шліфування, карбування, а згодом, у XIII ст, стругання, свердлування, точіння й полірування. Розвивалося виробництво скла, вітражів, дзеркал. У XII с т. з'явилися ткацький і токарний верстати, у ХІV-ХV - зубчасті передачі, свердлильний верстат, підйомний кран, вогнепальна зброя. Відбулися зміни і в суднобудуванні: на зміну однощогловим кораблям прийшли багатощоглові - каравели (XV ст.). У повсякденний вжиток увійшли окуляри і годинники, що стали справжніми подіями в історії Середньовіччя.
|
|
|
Середньовіччя відіграло важливу роль у культурному розвитку Європи. У цей період почали створюватися європейські нації і національні мови, виникали міста, разом з ними - ремесла, торгівля, створювалась багатогранна цивілізація, що сформувала обличчя сучасного європейця.
Обратимые реакции.
к1
А +В ↔ С + D
к2
 С Изменение концентрации веществ
С Изменение концентрации веществ
во времени исходных и конечных.
 t
t
Концентрация исходных веществ убывает до определенного момента.
1 – изменение концентрации исходных веществ.
2– изменение концентрации конечных продуктов во времени.
В момент равновесия Vпрямой = Vобратной, применив закон действующих масс:
К1[A] [B] = K2 [C] [D]
K = K0 * e –Е/RT
Главным в этом уравнении – это определение Е активации.
Для сложных реакций теория активных столкновений страдает рядом недостатков.
Оказалось, что экспериментальная константа скорости намного меньше теоретической, и это объясняется упрощенным характером теории, где соударение молекул похоже на столкновение шаров, где предполагается, что химическое взаимодействие происходит в момент столкновения.
Для того чтобы сделать уравнение применимым к эксперименту в него был введен поправочный коэффициент Р - стерический фактор (ориентация молекул в пространстве).
К = Р * K0 * e –Е/RT, поэтому теория активных столкновений оправдывает себя для реакций в газовой фазе.
В 1935 году Эйринг и Поляни представили теорию активированного комплекса (ТАК) или теорию переходного состояния.
Теория исходит из движения молекул и преодоления энергетического барьера. Однако она предполагает, что химическое взаимодействие осуществляется не в резкльтате столкновения, а в результате образования некторого промежуточного комплекса, в котором постепенно изменяются межатомные состояния, перераспределяется энергия по связям и конфигурация исходных веществ постепенно переходит в конфигурацию конечных продуктов.
А2 + В2 à 2 АВ
А –А А… А А А
+ à:: à +
В – В ß В… В В В
активный
комплекс
Е0 – энергия активации прямой реакции.
Разница энергий активированного комплекса и исходных веществ и есть
Е активации. Эта теория выражается так:
КБ * Т
К = h * е Sо*/R * e - ∆Ho*/RT (формула Болезена)
КБ – константа Больцмана
h - константа Планка
S0* - энтропия активированногго комплекса
Н0* - стандартная энтальпия
Сопоставим это уравнение с уравнением Аррениуса:
К = К0 * е –Е/RT, т.е. получится, что Е ≈ Н0*
К0 связана с ∆S0* (энтропией), поэтому через К0 можно рассчитать ∆S0*. Эта теория работает в водных растворах.
Определение Е активации.
I способ – графический.
Здесь определяют значение К при разных температурах, строят график зависимости ln K от 1 /T и находят тангенс угла наклона этой линии.
К = К0 * Е –Е /RT
E 1
ln К = ln K0 - R * T * X
y = b + kx (уравнение I порядка в матем.)
II способ – аналитический.
Здесь достаточно знать К всего при двух температурах.
Составляется система уравнений.
E
 ln K T1 = ln Ko – RT1
ln K T1 = ln Ko – RT1
E
ln KT2 = ln Ko – RT2
Вычитая из одного другое, приходим к следующему уравнению.
E E E
ln KT1 – ln KT2 = (ln Ko - RT1) – (ln Ko – RT2) = ln Ko – RT1 –
E E E E E
ln Ko + RT2 = - RT1 + RT2 = RT2 - RT1
KT1E
ln KT2 = R * (1 / T2 – 1 / T1)
KT1
E = R * ln KT2
1 _ 1
T2 T1
КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ
Скорость химической реакции при данной температуре определяется скоростью образования активированного комплекса, которая, в свою очередь, зависит от величины энергии активации. Во многих химических реакциях в структуру активированного комплекса могут входить вещества, стехиометрически не являющиеся реагентами; очевидно, что в этом случае изменяется и величина энергии активации процесса. В случае наличия нескольких переходных состояний реакция будет идти в основном по пути с наименьшим активационным барьером.
Катализ – явление изменения скорости химической реакции в
присутствии веществ, состояние и количество которых после
реакции остаются неизменными.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьщение скорости реакции), хотя часто под термином «катализ» подразумевают только положительный катализ; отрицательный катализ называют ингибированием.
Вещество, входящее в структуру активированного комплекса, но стехиометрически не являющиеся раегентом, называется катализатором. Для всех катализаторов характерны такие общие мвойства, как специфичность и селективность действия.
Каталитические реакции имеют ряд характерных особенностей.
1) Катализатор, участвуя в промежуточных стадиях, выделяется в первоначально взятом количестве и в свободном виде в конце реакции.
2) По сравнению с массами реагирующих веществ количество введенного катализатора ничтожно мало; например 1 кг платино-родиевой сетки (катализатор) способствует окислению в лкись азота 1 000 000 кг аммиака NH3.
3) Катализатор в одинаковой мере действует на скорость прямой и обратной реакций, т.е. смещения равновесия химической реакции при введении катализатора не наблюдается.
4) Действие катализаторов отличается специфичностью, а именно: данный катализатор, как правило, может влиять только на одну из реакций, не оказывая действия на другие. Действие катализатора характеризуется активностью (т.е. способностью ускорять процесс) и селективностью (т.е. способностью проводить процесс в определенном направлении).
Аl2O3
С2Н5ОН -------à С2Н4 + Н2О
3500С
Аl2O3
------à C2H5OC2H5 + H2O
2500C
Na
------à C4H4OH + H2O
Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не влиять на скорость других реакций. Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
5) Посторонние вещества по отношению к катализаторам могут быть нейтральными, полезными или вредными.
Селективность катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно, применяя различные катализаторы, из одних и тех же исходных веществ получать различные продукты:
[Cu]: СО + Н2 → СН3ОН [Al2O3]: С2Н5ОН → С2Н4 + Н2О
[Ni]: СО + Н2 → С2Н4 + Н2О [Cu]: С2Н5ОН → СН3СНО + Н2
Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции через активированный комплекс с участием катализатора.
Поскольку, согласно уравнению Аррениуса, константа скорости химической реакции находится в экспоненциальной зависимости от величины энеергии активации, уменьшение псоледней вызывает значительное увеличение константы скорости. Действительно, если предположить, что предэкспоненциальные множители в уравнении Аррениуса для каталитической некаталитической реакции близки, то для отношения скорости можно записать:
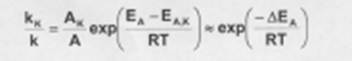
Если ∆ЕА = -50кДж/моль, то отношение констант скоростей составит 27 *105 раз (действительно, на практике такое уменьшение ЕА увеличивает скорость реакции приблизительно в 105 раз).
Необходимо отметить, что наличие катализатора не влияет на величину изменения термодинамического потенциала в результате процесса и, следовательно, никакой катализатор не может сделать возможным самопроизвольно протекание термодинамически невозможного процесса (процесса, ∆G (∆F) которого больше нуля). Катализатор не изменяет величину константы равновесия для обратимых реакций; влияние катализатора в этом случае заключается только в ускорении достижения равновесного состояния.
В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ.

Рис. Энергетическая диаграмма химической реакции без
катализатора (1) и в присутствии катализатора (2).
Гомогенный катализ.
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. В случае гомогенно-каталитических процессов катализатор образует с реагентами промежуточные реакционноспособные продукты. Рассмотрим некоторую реакцию
А + В → С
В присутствии катализатора осуществляются две быстро протекающие стадии, в результате которых образуются частицы промежуточного соединения АК и затем (через активизированный комплекс АВК#) конечный продукт реакции с регенацией катализатора:
А + К → АК
АК + В → С + К
Примером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой ЕА = 190 кДж/моль:
СН3СНО → СН4 + СО
В присутствии паров йода этот процесс протекает в две стадии:
СН3СНО + I2 → CH3I + HI + CO
CH3I + HI → СН4 + I2
Уменьшение энергии активации этой реакции в присутствии катализатора составляет 54 кДж/моль; константа скорсоти реакции при этом увеличивается приблизительно в 105 раз. Наиболее распространенным типом гомогенного катализа является кислотный катализ, при котором в роли катализатора выступают ионы водорода Н+.
Пример: башенный способ получения серной кислоты Н2SO4, при котором окисление SO2 в SO3 кислородом воздуха каталилизируется газообразными окислами азота (NO и NO2) и сопровождается образованием ряда промежуточных продуктов:
SO2 + NO2 à SO3 + NO
NO + 1 / 2 O2 à NO2
или суммарно:
SO2 + 1/ 2 O2 à SO3
Гетерогенный катализ
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа. В каждой гетерогенно-каталитической реакции можно выделить как минимум шесть стадий:
1. Диффузия исходных веществ к поверхности катализатора.
2. Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:
А + В + К → АВК
3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):
АВК → АВК#
4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:
АВК# → CDK
5. Десорбция продуктов реакции с поверхности катализатора.
CDK → C + D + K
6. Диффузия продуктов реакции от поверхности катализатора.
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Напрмиер, для катализируемой металлическим никелем реакции
СО + Н2 → СН4 + Н2О
Введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора.
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т.н. каталитических ядов). Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно.
Для объяснения этих особенностей гетерогенно-каталитических процессов Г. Тэйлором было высказано следующее предположение: каталитически активной является не вся поверхность катализатора, а лишь некоторые ее участки – т.н. активные центры, которыми могут являться различные дефекты кристаллической структуры катализатора (например, выступы либо впадины на поверхности катализатора). В настоящее время нет единой теории гетерогенного катализа. Для металлических катализаторов была разработана теория мультиплетов. Основные положения мультиплетной теории состоят в следующем:
1. Активный центр катализатора представляет собой совокупнсоть определенного числа адсорбционных центров, расположенных на поверхности катализатора в геометрическом соответствии со строением молекулы, претерпевающей превращение.
2. При адсорбции реагирующих молекул на активном центре образуется мультиплетный комплекс, в результате чего происходит перераспределение связей, приводящее к образованию продуктов реакции.
Теорию мультиплетов называют иногда теорией геометрического подобия активного центра и реагирующих молекул. Для различных реакций число адсорбционных центров (каждый из которых отождествляется с атомом металла) в активном центре различно – 2,3,4 и т.д. Подобные активные центры называются соотвественно дублет, триплет, квадруплет и т.д. (в общем случае мультиплет, чему и обязана теория своим названием).
Например, согласно теории мультиплетов, дегидрирование предельных одноатомных спиртов происходит на дублете, а дегидрирование циклогексана – на секстете (рис.2.10-2.11); теория мультмплетов позволила связать каталитическую активность металлов с величиной их атомного радиуса.

Ферментативный катализ.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы.
Ферменты или энзимы – специфические белки, выполняющие каталитические функции в живых системах.
Особенности ферментативного катализа: все процессцы в организме идут при t = 370С, а вне организма при t = 4000С.
Каждый фермент катализирует только одну реакцию.
Ферменты действуют в узком интервале рН.
Пример: трипсин способен проявлять свою активность от 8 до 8,5 рН.
пепсин - от 1,5 до 2 рН.
Ферменты работают в определенной области температур. При понижении температуры активность ферментов снижается, но при восстановлении оптимальных температур активность восстанавливается (такой вид используется при операциях на грудной клетке, t0 – понижают до 22ОС).
При повышении t0С активность фермента увеличивается, но до некоторого предела, т.к. выше – происходит денатурация белков, инактивация фермента и выход его из строя.
Ферментативный катализ имеет две характерные особенности:
1. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами. Так, константа скорости реакции разложения перекиси водорода, катализируемой ионами Fe2+, сотавляет 56 с-1; константа скорости этой же реакции, катализируемой ферментом каталазой, равна 3,5 *107,т.е. реакция в присутствии фермента протекает в миллион раз быстрее (энергии активации процессов составляет 42 и 7,1 кДж/моль). Константы скорости гидролиза мочевины в присутствии кислоты и уреазы различаются на принадцать порядков, составляя 7,4 * 10-7 и 5 * 106 с-1 (величина энергии активации составляет соответственно 103 и 28 кДж/моль).
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного ферментов.
Согласно общепринятым представлениям о механизме ферментативного катализа, субстрат S и фермент F находится в равновесии с очень быстро образующимся фермент-субстратным комплексом FS, который сравнительно медленно распадается на продукт реакции Р с выделением свободного фермента; т.о., стадия распада фермент – субстратного комплекса на продукты реакции является скоростьопределяющей (лимитирующей).
Механизм действия катализаторов – ферментов:
S + F = S F ---------à P + F
субстрат фермент
(энзим) продукт
энзимсубстратный
комплекс
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться (рис.2.12) и зависимость скорости реакции от концентрации субстрата описывается следующим уравнением:
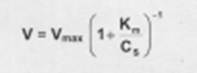
Здесь Кm – константа Михаэлиса, численно равная концентрации субстрата при V = ½ Vmax. Константа Михаэлиса служит мерой сродства между субстратом и ферментом: чем меньше Кm, тем больше их способность к образованию фермент-субстратного комплекса.
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям –рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значен6ии рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.

Автокатализ.
Автокатализ – процесс каталитического ускорения химической реакции одним из ее продуктов.
Пример: Можно привести катализируемую ионами водорода реакцию гидролиза сложных эфиров. Образующаяся при гидролизе кислота диссоциирует с образованием протонов, которые ускоряют реакцию гидролиза.омыление сложных эфиров в отсутствие в в реакционной смеси кислоты.
СН3 СООС2Н5 + Н2О → СН3 СООН + С2 Н5ОН
Особенность автокаталитической реакции состоит в том, что данная реакция протекает с постоянным возрастанием концентрации катализатора. Поэтому в начальный период реакции скорость ее возрастает, а на последующих стадиях в результате убыли концентрации реагентов скорость начинает уменьшаться; кинетическая кривая продукта автокаталитической реакции имеет характерный S – образный вид (рис).

Работа катализа.
Если скорость реакции увеличивается, то катализ называется положительным. Если скорость реакции уменьшается, то катализ называется отрицательным.
В пятницу 12 апреля состоится:
Открытая бесплатная лекция на тему:
«ВВЕДЕНИЕ В КИНОТЕРАПИЮ,
КИНОТРЕНИНГ, КИНОКЛУБ»
Формат программы: лекция, тренинг, неформальное общение, ролевое моделирование, представление случаев из практики, дискуссии, видео просмотр с методическим анализом, работа с кейсами, разработка видео упражнений.
Организаторы: Факультет педагогики и психологии МПГУ, МОСПИ, Компания «Искусство Тренинга», Благотворительный Фонд «Фостер Форсайт», Самарский Государственный Университет.
Программа будет интересно всем:
· кто ведет активную психологическую и педагогическую практику и хочет освоить современные методы работы;
· кто хочет научиться разрабатывать и успешно проводить собственные кино упражнения, занятия, тренинги;
· кто хочет найти свежие и не избитые практические формы работы с учениками и клиентами и украсить свою консультационную, тренинговую, преподавательскую деятельность;
Вопросы, на которые Вы найдете ответы:
· история возникновения кинотерапии как одного из направлений психотерапевтической работы;
· научные подходы и теории, лежащие в основе кинотерапии;
· области применения кинотерапии в психолого-педагогической практике.
· краткий обзор методов кинотерапии;
Ведущий: Березин Сергей Викторович, к.п.н., практикующий психотерапевт, заведующий кафедры социальной психологии Самарского государственного университета, автор единственного русскоязычного пособия по кинотерапии.
Место проведения: МПГУ, Факультет педагогики и психологии.
Время: 19:00-21.30.
Записаться на лекцию и тренинг и задать интересующие Вас вопросы:
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 305; Нарушение авторских прав?; Мы поможем в написании вашей работы!