
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости при повышении температуры увеличивается
|
|
|
|
Произведение растворимости малорастворимого сильного электролита есть произведение равновесных молярных концентраций катионов и анионов этого электролита в насыщенном водном растворе.
Для электролита более сложного состава A a B b произведение растворимости выражается следующим образом:
a А b + + b В a - Û A a B b (5)
ПР=[А b +] a [В a -] b. (6)
Пример. Для ортофосфата кальция:
3Ca2+ +2PO43- Û Ca3(PO4)2 (т) ; ПР= [Ca2+ ]3[PO43- ]2 (250C)
Если в растворе концентрация электролита выше значения ПР, то избыточное количество вещества выпадает в осадок. Поэтому условием выпадения осадка для электролита АВ будет соотношение:
СА+СВ-> ПР (осадок выпадает), (7)
где - СА+ и СВ- - концентрации ионов А+ и В- в растворе электролита.
Если условие выпадения осадка не выполняется, т.е.
СА+СВ-< ПР, (8)
то осадок малорастворимого вещества не образуется.
Между произведением растворимости и растворимостью L (моль/л) малорастворимого электролита существует взаимосвязь. Для электролита АВ она имеет следующее математическое выражение:
А+ + В- Û АВ(т); ПР =[А+][В-]
[А+]=[В-]=L
ПР =[А+][В-]=L2 или
L=ÖПР (9)
Пример. Растворимость хлорида серебра (I) при 250C составляет:
Аg+ + Cl Û АgCl(т); ПР =1,8*10-10,
L=ÖПР=Ö1,8*10-10=1,3*10-5 моль/л.
Очевидно, что концентрация обоих ионов также равна 1,3*10-5 моль/л.
Аналогично, для электролитов типа A 2 B или AB 2 взаимосвязь между ПР и L следующая:
3
L=ÖПР/4. (10)
В общем виде выражение растворимости для малорастворимого сильного электролита A a B b имеет вид:
a+b
L=ÖПР/ abba. (11)
Поскольку из одной формульной единицы электролита образуется несколько ионов А b + и В a - (a и b соответственно), то
[А b +]= a L и [В a -]= b L.
Как и всякая константа равновесия величина ПР зависит от температуры, т.к. растворимость вещества (концентрация насыщенного раствора) изменяется при повышении или понижении температуры.
|
|
|
Для малорастворимых сильных электролитов, растворимость которых с ростом температуры увеличивается,
4.2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
4.2.1. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Окислительно-восстановительные реакции – это реакции, в результате которых изменяюется степень окисленности элементов.
Окисленность – неравномерность распределения электронов между атомами в соединениях.
- Элемент, электроны которого смещаются к атомам другого элемента (полностью в случае ионной связи и частично в случае ковалентной полярной), проявляет положительную окисленность.
- Элемент, к атомам которого смещаются электроны атома другого элемента, проявляет отрицательную окисленность.
Степень окисленности (с.о.) – число электронов, смещённых от одного атома данного элемента (при положительной окисленности) или к одному атому данного элемента (при отрицательной окисленности).
В простых веществах степень окисленности всегда равна 0.
В химических соединениях некоторые элементы проявляют всегда одну и ту же степень окисленности, но для большинства элементов она в различных соединениях различна.
Для элементов с непостоянной степенью окисленности её значение можно подсчитать, зная формулу соединения и учитывая, что сумма с.о. всех атомов в молекуле равна 0.
В окислительно-восстановительных реакциях степень окисленности элементов изменяется.
Пример: 
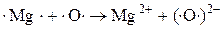

При окислении Mg молекулярным  каждый атом Mg передаёт 2 валентных электрона атому О.
каждый атом Mg передаёт 2 валентных электрона атому О.
Таким образом, в соответствии с теорией электронного строения атома окислительно-восстановительные реакции интерпретируются как процессы отдачи и приёма электронов. Электроны не уходят из сферы реакции, а переносятся от одного элемента (восстановителя) к другому (окислителю).
|
|
|
Окислительно-восстановительную реакцию можно представить в виде двух полуреакций.
Полуреакция окисления (отдача электронов): 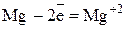
Полуреакция восстановления (приём электронов): 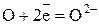
Число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равен числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. В рассмотренном примере 1 молекула кислорода -  окисляет 2 атома магния -
окисляет 2 атома магния - 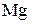 .
.
Окисление – это процесс отдачи электронов.
Восстановление – это процесс приёма электронов.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается. Степень окисления при этом понижается. (с.о. 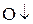 )
)
Восстановитель – вещество, которое отдаёт электроны и при этом окисляется. Степень окисления при этом возрастает. (с.о. 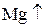 )
)
ВОССТАНОВИТЕЛИ
1) Среди элементарных веществ – активные металлы и некоторые неметаллы.
К отдаче электронов склонны атомы элементов, у которых во внешнем электронном слое содержится малое число электронов.
При отдаче этих электронов устойчивый внутренний электронный слой становится внешним.
(Mg - 2e: 2 - внутренний слой стал внешним)
- внутренний слой стал внешним)
8 электронов образуют устойчивый октет.
Следовательно, восстановителями являются:
- активные металлы: щелочные, щелочноземельные, Al, Zn, Fe и другие
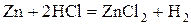
- некоторые неметаллы: 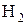 , C (в виде угля или кокса), P, Si
, C (в виде угля или кокса), P, Si

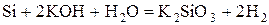 .
.
2) Бескислородные кислоты (HCl, HBr,  ) и их соли.
) и их соли.
Носителями восстановительной функции являются анионы. Окисляясь, они образуют элементарные вещества.
В ряду галогенид–ионов восстановительные свойства возрастают от 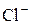 до
до  .
.
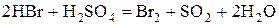 .
.
3) Гидриды щелочных и щелочноземельных металлов, содержащие ион  .
.
Окисляются до 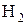 .
.
 .
.
4) Ионы металлов, находящиеся в низшей степени окислен ия (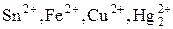 и другие).
и другие).
Способны увеличивать с.о.. при взаимодействии с окислителем.
 .
.
4.2.2. ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ.
1) Среди элементарных веществ – типичные неметаллы.
К приему электронов склонны атомы элементов, которым не хватает лишь небольшого числа электронов для образования устойчивого внешнего электронного слоя.
Это типичные неметаллы: галогены в свободном виде 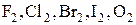 .
.
Галогены восстанавливаются до -1: 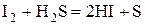 .
.
Кислород восстанавливается до -2:  .
.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!