
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коллоидная химия
|
|
|
|
Металлы металлы металлы
Наиболее неблагородные менее неблагородные благородные
K+ Na+ Mg2+ Al3+ H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ Cu2+ Ag+
Трудно разряжаемые ---------------------------------------------® легко разряжаемые
Продукты электролиза в водном растворе:
только Н2 металл и Н2 только металл
Для распространенных анионов имеется следующий ряд разряжаемости на аноде:
кислородосодержащие
кислотные остатки OH- Cl- Br- I-
(SO42- NO3- и т.п.)
Трудно разряжаемые ---------------------------------------------® легко разряжаемые
С помощью этих рядов легко определить, какими будут продукты электролиза для водных растворов различных электролитов.
Большинство веществ окружающего нас мира существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Свойства вещества в раздробленном, или дисперсном, состоянии отличаются от свойств того же вещества в недисперсном состоянии. Под дисперсным состоянием понимают состояние системы, в котором одно вещество (дисперсная фаза) распределено в другом (дисперсионная среда или фаза).
Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. Диспергирование (измельчение) вещества приводит к возникновению избытка свободной энергии поверхностных слоев, т. е. тонких слоев вещества на границе соприкосновения тел (сред, фаз). Особые свойства поверхностных слоев отражаются в п ов е рхностных явл е ниях. Раздел химии, в котором изучаются дисперсные системы и поверхностные явления называется коллоидной химией.
В коллоидной химии изучаются такие явления, как адгезия, адсорбция, смачивание, коагуляция, электрофорез. Разрабатываются технологии строительных материалов, бурения горных пород, зол-гель технологии. Коллоидная химия играет фундаментальную роль в нанотехнологии.
|
|
|
8.1. ДИСПЕРСНЫЕ СИСТЕМЫ
Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе (дисперсионной среде) (рис.8.1).
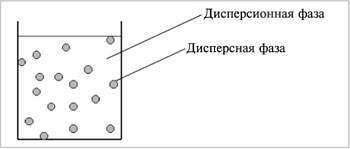
|
| Рис.1. Дисперсная система |
Существует несколько различных классификаций дисперсных систем: 1) по размеру частиц, 2) по фазовому состоянию дисперсной фазы и дисперсионной среды, 3) по характеру взаимодействия частиц дисперсной фазы с веществом дисперсионной среды, 4) по термодинамической и кинетической устойчивости дисперсных систем и т.п.
1) Размер частиц дисперсной фазы характеризуется дисперсностью.Cтепень раздробленности вещества дисперсной фазы называется степенью дисперсности D:.
D = 1/ a см-1…………........................................(1),
где a – размер дисперсных частиц. Под a понимается либо диаметр сферических или волокнистых частиц, либо длина ребра кубических частиц, либо толщине пленок.
Степень дисперсности численно равна числу частиц, которые можно плотно уложить в ряд на протяжении одного сантиметра.
Чем больше степень дисперсности, тем меньше размер частиц.
В зависимости от дисперсности дисперсные системы можно разделить на высокодисперсные, или собственно коллоидные, и низкодисперсные (грубодисперсные).
Высокодисперсные системы в зависимости от размера частиц подразделяют на ультрамикро- и микрогетерогенные системы
Таблица 8.1.
Классификация дисперсных систем в зависимости от размера частиц дисперсной фазы
| Название | Размер частиц, м |
| Ультрамикрогетерогенные | 10−9…10−7 |
| Микрогетерогенные | 10−7…10−5 |
| Грубодисперсные | более 10−5 |
Ультрамикрогетерогенные системы также называют коллоидными или золями. В зависимости от природы дисперсионной среды, золи подразделяют на твёрдые золи, аэрозоли (золи с газообразной дисперсионной средой) и лиозоли (золи с жидкой дисперсионной средой).
|
|
|
К микрогетерогенным системам относят суспензии, эмульсии, пены и порошки. Наиболее распространёнными грубодисперсными системами являются системы «твёрдое — газ», например, песок.
Размер частиц высокодисперсных систем как минимум, на порядок больше размера частиц в истинных растворах (т.е. растворах, в которых частицы не могут быть обнаружены оптическим путем). В ионных растворах размер частиц менее 1×10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах с размером частиц 1×10−9 м — 5×10−7 м их можно обнаружить при помощи ультрамикроскопа (эффект Тиндаля).
Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами — полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.
2) Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы.
Таблица 8.2.
Классификация дисперсных систем по агрегатному состоянию дисперсионной среды и дисперсной фазы.
| Дисперс- ная фаза | Дисперсионная среда | Обоз-на-чение | Название системы | Примеры |
| Газ | Газ | г/г | (Дисперсная система не образуется.)– | |
| Жидкость | г/ж | Газовая эмульсия и пена | Газированная вода, пузырьки газа в жидкости, мыльная пена | |
| Твердое тело | г/т | Твердая пена (пористое тело) | Пенопласт, микропористая резина, пемза, хлеб, сыр | |
| Жидкость | Газ | ж/г | Жидкая арозоль | Туман, облака, струя из аэрозольного баллона |
| Жидкость | ж/ж | Эмульсия | Молоко, сливочное масло, майонез, крем, мазь, нефть | |
| Твердое тело | ж/т | Твердая эмульсия (капиллярная система) | Жемчуг, опал, жидкость в пористых телах, грунт, почва | |
| Твердое тело | Газ | т/г | Аэрозоль, порошок | Пыль, дым, мука, цемент |
| Жидкость | т/ж | Суспензия, золь (коллоидный раствор) гель, паста | Глина, паста, ил, жидкие смазочные масла с добавкой графита или MoS | |
| Твердое тело | т/т | Твердый золь (Твёрдые гетерогенные системы) | Сплавы, бетон, цветные стекла, минералы, композиционные материалы |
3) Большая поверхность раздела фаз вызывает сильное взаимодействие частиц дисперсной фазы с дисперсионной средой, которое приводит к тому, что частицы дисперсной фазы окружаются молекулами и ионами дисперсионной среды (растворителя) или же приобретают довольно значительный электрический заряд.
|
|
|
По силе взаимодействия дисперсной фазы с дисперсионной средой коллоидные системы разделяют на лиофильные (от греч. 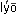 – растворяю,
– растворяю,  – люблю) и лиофобные (от греч.
– люблю) и лиофобные (от греч. 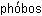 – страх). Эти названия указывают на то, что в лиофильных коллоидных системах взаимодействие частиц с веществом дисперсионной среды сильнее, чем в лиофобных.
– страх). Эти названия указывают на то, что в лиофильных коллоидных системах взаимодействие частиц с веществом дисперсионной среды сильнее, чем в лиофобных.
8.2. ЛИОФИЛЬНЫЕ И ЛИОФОБНЫЕ СИСТЕМЫ
Лиофильные дисперсные системы характеризуются сильным притяжением молекул дисперсионной среды к частицам дисперсной фазы. Вокруг частиц самопроизвольно образуются плотные и сравнительно устойчивые сольватные оболочки. При взаимодействии с молекулами воды говорят о гидрофильности дисперсной фазы и образовании гидратных оболочек. Если частицы распределены в маслоподобных органических веществах и окружены такими оболочками, говорят об олеофильности частиц. Лиофильные вещества (тела) растворяются в данной жидкости, набухают в ней или хорошо смачиваются.
В лиофильных коллоидах поверхность частиц сильно сольватирована и поверхностная энергия (поверхностное натяжение) на границе раздела фаз мала. Лиофильные коллоиды образуются в результате самопроизвольного диспергирования крупных частиц твердого вещества или капель жидкости на мельчайшие коллоидные частицы (или мицеллы). Лиофильные коллоиды термодинамически устойчивы и поэтому почти не разрушаются при постоянстве условий их образования.
Лиофильные системы самопроизвольно образуются в жидкостях без участия электролитов или поверхностно-активных веществ. Так, гидрофильные системы образуют желатин и крахмал, которые сначала набухают в воде и затем переходят в раствор (студень, кисель, крахмальный клей); альбумины, в том числе яичный белок, также растворяются в воде; натуральный каучук легко растворяется в бензине (резиновый клей). К лиофильным коллоидным системам относятся растворы обычного мыла в воде.
|
|
|
Важнейшая характеристика дисперсных систем – знак и величина заряда частиц. У частиц лиофильных коллоидов заряд или очень мал, или вообще отсутствует. Заряд на частице лиофильного коллоида изменяется очень легко при прибавлении небольших количеств электролитов. Изменение концентрации ионов водорода в растворе (рН) приводит к перезарядке частиц коллоидного раствора. В электрическом поле лиофильные коллоиды или не перемещаются, или перемещаются в любом направлении.
Лиофобные дисперсные системы характеризуются слабым взаимодействием между молекулами дисперсионной среды и частицами дисперсной фазы. Если дисперсионной средой является вода, говорят о гидрофобности системы, если органические маслоподобные вещества – об ее олеофобности. Частицы лиофобных веществ (тела) не растворяются, плохо смачиваются и не набухают в веществе дисперсионной среды. Лиофобные системы с концентрацией дисперсной фазы выше 1% получить не удается, а лиофильные коллоидные системы могут быть очень концентрированными.
О лиофильности или лиофобности системы можно судить по количеству теплоты, выделяющейся при растворении, набухании и смачивании. У лиофильных систем теплота взаимодействия намного больше, чем у лиофобных.
На гладкой поверхности лиофильного вещества капля жидкости растекается, образуя тонкий слой (пленку), а на лиофобной поверхности капля не растекается, образуя линзу или сплющенный шар. Количественной мерой лиофобности может служить величина угла между поверхностями капли и смачиваемого тела (краевой угол, или угол смачивания).
Лиофобные коллоидные системы по вязкости близки к дисперсионной среде, лиофильные системы имеют более высокую вязкость.
Лиофильные коллоидные растворы рассеивают свет слабее лиофобных.
Типичные лиофобные вещества – оксиды или сульфиды элементов металлического характера.
Принципиальное различие лиофобных и лиофильных коллоидных систем состоит в их термодинамических свойствах. Лиофобные системы – гетерогенные, и в этом отношении их нельзя относить к истинным растворам. Лиофильные системы – однофазные, гомогенные, обладающие многими свойствами истинных растворов. Вследствие высокой поверхностной энергии лиофобные системы термодинамически и кинетически неустойчивы. Лиофильные системы термодинамически устойчивы.
При распаде лиофобных коллоидов происходит укрупнение коллоидных частиц, которое сопровождается уменьшением энергии системы. Способность противостоять укрупнению частиц (агрегативная устойчивость) у лиофобной системы имеет временный характер и часто обусловлена наличием веществ (стабилизаторов), адсорбирующихся на поверхности частиц и препятствующих их слипанию (или слиянию).
8.3.СУСПЕНЗИИ, ЗОЛИ. ГЕЛИ
Суспензии, или взвеси- грубодисперсные системы типа «твердое вещество–жидкость» со сравнительно крупными (больше 1•10–3 мм) частицами. Частицы суспензий не обнаруживают броуновского движения. Суспензии с плотностью больше, чем плотность дисперсионной среды, выпадают в осадок; если же их плотность меньше, частицы всплывают.
Поскольку размеры частиц относительно велики, суспензии кинетически неустойчивы, и при отстаивании частицы выпадают в осадок. Процесс выделения суспендированных частиц, происходящий под действием силы тяжести, называется седиментацией, или осаждением. В начале седиментации выпадают самые крупные частицы. Скорость осаждения частиц зависит от соотношения плотностей фаз, вязкости жидкой фазы, радиуса частиц, степени их гидрофильности, присутствия поверхностно-активных веществ и других факторов.
По размерам частиц промежуточное положение между суспензиями и истинными растворами занимают золи.
Золи – высокодисперсные системы с частицами из твердого вещества, находящимися в броуновском движении. Чаще всего золями называют системы с жидкой дисперсионной средой. Золи – типичные коллоидные системы, которые наиболее ярко проявляют свойства, присущие веществу в высокодисперсном состоянии.
Золи диффундируют медленнее, чем неорганические соли, обладают эффектом светорассеяния (Эффект Тиндаля).
Строение золей и их получение подробно рассмотрено в методическом указании «Методы получения золей».
Ге́ли (от лат. gelo — «застываю») — структурированные дисперсные системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Наличие трёхмерного полимерного каркаса (сетки) сообщает гелям механические свойства твёрдых тел (отсутствие текучести, способность сохранять форму, прочность и способность к деформации (пластичность и упругость)). В отличие от золей частицы дисперсной фазы гелей, связанные в пространственную структуру, не могут участвовать в броуновском движении.
Гели состоят, по крайней мере, из двух компонентов, один из которых образует непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса, пустоты в которой заполнены низкомолекулярным растворителем — дисперсионной средой.

Рис. 2. Образование трёхмерного каркаса гидрогеля SiO2
Вещества, способные образовывать макромолекулярную структуру гелей, называются гелеобразователями. К ним относятся как неорганические (диоксид кремния, оксид алюминия, так и органические вещества и их смеси (поливиниловый спирт, полиакриламид, желатина, агар-агар, пектиновые вещества и др.). В качестве низкомолекулярной дисперсионной среды — наполнителя геля — выступают вода, низшие моно- и олигоспирты, углеводороды. Гели с водной дисперсионной средой называются гидрогелями, со спиртовой — алкогелями, с углеводородной — органогелями (общее название «лиогели»).
Гели образуются при коагуляции и последующей коалесценции (слияния частиц) золей, понижении температуры, концентрировании мицеллярных растворов мыл или выделении новой дисперсной фазы из пересыщенных растворов.
Удалением из лиогелей жидкой среды можно получить тонкопористые тела (аэрогели или ксерогели), в которых дисперсная фаза превращается в прочные адгезионные или фазовые (когезионные) пористые структуры. Таковы алюмогель и силикагель, получаемые высушиванием гидрогелей гидроксида алюминия и кремниевых кислот.
Гели термодинамически неустойчивы: вследствие синерезиса (самопроизвольного уменьшение объёма, сопровождающееся отделением жидкости) дисперсная система самопроизвольно разрушаются с выделением жидкой концентрированной фазы в результате самопроизвольного уплотнения структурной сетки. При удалении низкомолекулярного растворителя (высушивании) гели, обычно, необратимо разрушаются.
8.4. МЕТОДЫ ИССЛЕДОВАНИЯ ДИСПЕРСНЫХ СИСТЕМ
Методы исследования дисперсных систем (определение размера, формы и заряда частиц) основаны на изучении их особых свойств, обусловленных гетерогенностью и дисперсностью, в частности оптических.
Коллоидные растворы обладают оптическими свойствами, отличающими их от настоящих растворов, – они поглощают и рассеивают проходящий через них свет. При боковом рассматривании дисперсной системы, через которую проходит узкий световой луч, внутри раствора на темном фоне виден светящийся голубоватый так называемый конус Тиндаля (рис. 3). То же самое происходит, когда мы замечаем в пыльной комнате светлую полосу солнечного света из окна. Это явление называется опалесценцией.
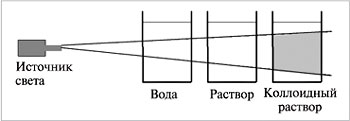
|
| Рис.3. Эффект Тиндаля (опалесценция) |
Рассеяние света возможно, если размер коллоидной частицы меньше длины волны проходящего света и показатели преломления дисперсной фазы и дисперсионной среды различны. Размеры коллоидных частиц меньше длин волн видимой части спектра (примерно 0,1–0,2 длины волны света), и поглощенная световая энергия вновь испускается частицами в различных направлениях, что проявляется в рассеивании света. Интенсивность светорассеяния резко увеличивается с уменьшением длины световой волны.
Конус Тиндаля тем ярче, чем выше концентрация и больше размер частиц. Интенсивность светорассеяния усиливается при коротковолновом излучении и при значительном отличии показателей преломления дисперсной и дисперсионной фаз. С уменьшением диаметра частиц максимум поглощения смещается в коротковолновую часть спектра, и высокодисперсные системы рассеивают более короткие световые волны и поэтому имеют голубоватую окраску. На спектрах рассеяния света основаны методы определения размера и формы частиц.
Размеры частиц золей обычно равны 10–3–10–5 мм, что позволяет им участвовать в броуновском движении – непрерывном беспорядочном перемещении мельчайших частиц в жидкости или газе.
Броуновское движение можно наблюдать при помощи микроскопа. Частица перемещается из-за различного числа одновременных ударов неодинаковой силы молекулами дисперсионной среды (рис.4).
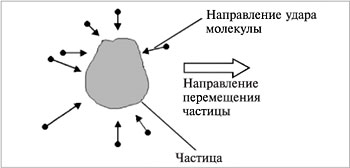
|
| Рис.4.Перемещение частицы в дисперсионной среде |
Частицы дисперсных систем имеют различные размеры, и их распределение по размерам описывается кривыми, похожими на кривые распределения молекул газа по энергиям и скоростям. Распределение частиц дисперсной фазы по размерам показано на рис.5.
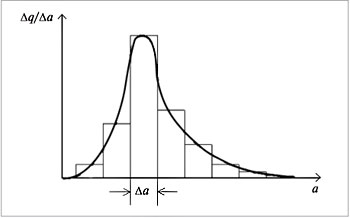
|
| Рис.5. Кривая распределения частиц дисперсной фазы по размерам и ее построение |
На оси абсцисс откладывают размер частиц а, на оси ординат – долю частиц 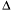 q/
q/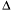 a, имеющих данный размер а. Подобного типа кривые могут быть симметричными, несимметричными (как на рис.5) и даже с несколькими максимумами.
a, имеющих данный размер а. Подобного типа кривые могут быть симметричными, несимметричными (как на рис.5) и даже с несколькими максимумами.
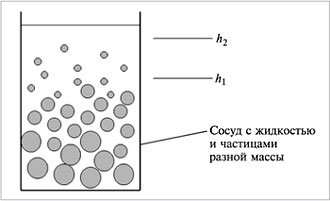
Броуновское движение препятствует седиментации (оседанию) частиц под действием силы тяжести и является одной из причин устойчивости дисперсных систем. Благодаря броуновскому движению частицы в зависимости от их массы (и плотности) распределяются в поле тяготения по высоте
(рис.6). Такое распределение частиц называется седиментационным равновесием. Оно обнаруживается в жидких и воздушных средах. Внизу сосуда с жидкостью или водоема скапливаются частицы с большей массой.
|
| Рис.6. Седиментационное равновесие |
После выведения системы из седиментационного равновесия перемешиванием через некоторое время она снова возвратится в исходное состояние. Скорость установления седиментационного равновесия невысока, и оно может наступить через несколько дней, но затем будет сохраняться, пока не произойдет разрушения золя.
9. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИННИЯ
Имеют большую молекулярную массу и состоят из большого числа периодически повторяющихся фрагментов -элементарных (структурных) звеньев.

Мономеры(1)→ олигомеры→ полимеры (макромолекулы)
Признаки полимеров: 1. очень большая молекулярная масса (десятки и сотни тысяч). 2. цепное строение молекул (чаще простые связи).
По форме макромолекул (шарик - структурное звено). ↓ Линейная форма (полиэтилен низкого давления, невулканизованный нат. каучук)  Разветвленная форма (полиэтилен высокого давления) →
Разветвленная форма (полиэтилен высокого давления) →  Пространственная (трехмерная или сетчатая) форма (вулканизованный каучук):
Пространственная (трехмерная или сетчатая) форма (вулканизованный каучук):

Линейные и разветвленные полимеры термопластичны, растворимы;
· линейные полимеры имеют наибольшую плотность,
· полимеры сетчатого строения, не плавятся, не растворяются
· Сетчатые структуры могут быть получены из термореактивных полимеров. По стереорегулярности: Структурные звeнья несимметричного строения, например,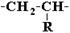
могут соединяться между собой двумя способами:
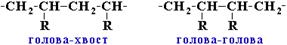
- (Стерео) регулярные полимеры - макромолекулы построены одним из этих способов --Полимеры нерегулярного строения образованы произвольным сочетанием 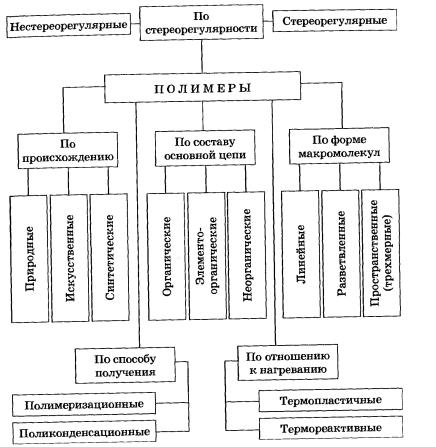
По происхождению: Искусственные полимеры – из природных органических полимеров (ацетилцеллюлоза или ацетатный шелк - из целлюлозы) Синтетические полимеры - из органических низкомолекулярных соединений. По составу основной цепи: Органические:I. Карбоцепные – осн.цепи построены только из атомов С. II. Гетероцепные –помимо С, содержат гетероатомы (O,N,P,S и т.д.) Каучуки, целлюлоза, крахмал, органическое стекло Элементоорганические – основные цепи макромолекул содержат элементы, не входящие в состав природных органических соединений (Si, Al, Ti, B, Pb, Sb, Sn и др.) Неорганические: кварц, силикаты, алмаз, графит, корунд, карбин, карбид бора. –. Органические природные п олимеры – биополимеры: (обеспечивают процессы жизнедеятельности животных и раститений) 1. Нуклеиновые кислоты -ДНК, РНК (построены из:азотистое основание+ моносахарид+ остаток фосфорной кислоты) 2. Белки -полипептиды (из остатков α-аминокислот) 3. Полисахариды - целлюлоза, крахмал, гликоген (из ост. моносахаридов;. – целлюлоза, крахмал из глюкозы) 4. Полиизопрены -натуральный каучук, гуттаперча и др. (из1,4- цис -изопрена)
По отношению к нагреванию: Термопластичные - полимеры линейной или разветвлённой структуры. Свойства обратимы при многокр.нагревании и охлаждении; Термореактивны е - некоторые линейные и разветвлённые полимеры, макромолекулы которых при нагревании соединяются друг с другом; при этом образуются пространственные сетчатые структуры. После прогрева обычно становятся неплавкими и нерастворимыми – происходит процесс их необратимого отверждения.
По способу получения: 1.Полимеризация –последоват. присоединение молекул мономера к растущей цепи.
1. В основе лежит реакция присоединения.
2.Является цепным процессом, т.к. включает стадии инициирования, роста и обрыва цепи.
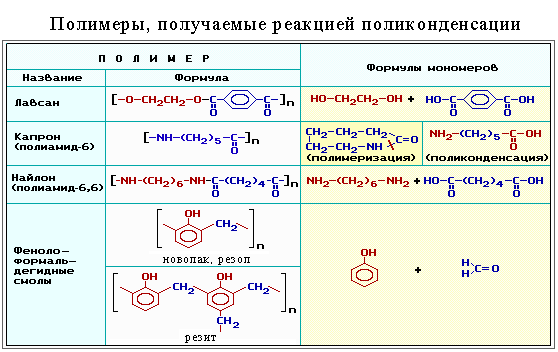
3. Элементный состав (молекулярные формулы) мономера и полимера одинаков. 2.Пoликонденсация – протекает по механизму замещения и сопровождается выделением побочных низкомолекулярных продуктов. Получение капрона из ε-аминокапроновой кислоты: n H2N-(CH2)5-COOH  H-[-NH-(CH2)5-CO-]n-OH + (n-1) H2O;
H-[-NH-(CH2)5-CO-]n-OH + (n-1) H2O;



Физическое состояние полимеров: аморфное или кристаллическое.
Аморфное состояние - отсутствием упорядоченности в расположении макромолекул. Для аморфных полимеров возможны 3 состояния: стеклообразное, высокоэластическое и вязкотекучее.
Кристаллическое состояние возможно лишь для стереорегулярных полимеров
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2256; Нарушение авторских прав?; Мы поможем в написании вашей работы!