
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип метода
|
|
|
|
По своему принципу потенциометрический метод ничем не отличается от приборной рН-метрии. Ионселективный электрод заполнен внутри раствором соли исследуемого иона с концентрацей порядка 10-1 М/л. Например, при изуччении концентрации иона калия для заполнения ИСЭ пригодны растворы KCl, KNO3 данной концентрации. Электрод сравнения служит показателем нулевого потенциала раствора. При помещении ИСЭ и электрода сравнения в раствор с исследуемым ионом происходят следующие события:
1. Ионы исследуемого вещества обратимо присоединяются к чувствительной мембране ИСЭ.
2. В результате присоединения ионов на внешней стороне мембраны происходит накопление заряда. При присоединении катионов на внешней стороне накапливается положительный заряд, а при присоединении анионов – отрицательный. Величина заряда пропорциональна количеству присоединенных исследуемых ионов, то есть, в конечном итоге, их концентрации.
3. Накопление положительного или отрицательного заряда на внешней стороне мембраны ИСЭ вызывает обратимое осаждение на ней изнутри ионов из раствора, которым заполнен ИСЭ. Эти ионы имеют заряд, противоположный тому, который имеют ионы исследуемого вещества. В результате мембрана ИСЭ поляризуется. Перемещение ионов изменяет и делает отличным от нуля окислительно-восстановительный потенциал раствора в районе погруженного в него контакта ИСЭ.
4.
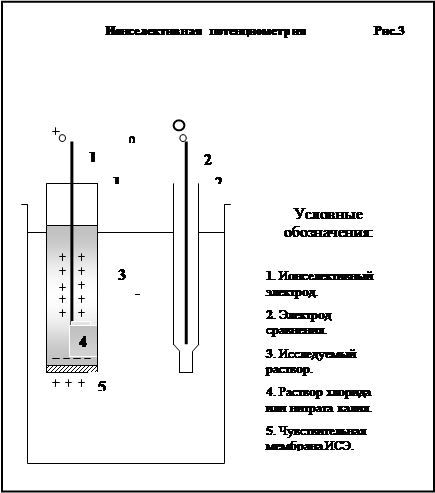
5. Изменение окислительно-восстановительного потенциала во внутреннем растворе ИСЭ приводит, таким образом, к накоплению заряда на контакте ИСЭ. Знак заряда равен знаку заряда исследуемых ионов, а его величина – их концентрации в исследуемом растворе.
6. Таким образом на выводах ИСЭ и электрода сравнения возникает постоянное напряжение, величина которого пропорциональна концентрации исследуемого иона, а полярность – его заряду.
7. Полученный постоянный сигнал электронной пары направляется в ионометр, а также, если необходимо, на другую регистрирующую аппаратуру.
Графически принцип работы ионселективной техники на примере измерения концентрации иона калия представлен на Рис..
Методика проведения исследований.
Если ионселективные электроды используются впервые, то предварительно необходимо заполнить их растворами солей с соответствующими ионами. Растворы для заполнения зачастую продаются в комплекте с ИСЭ. Кроме того, перед началом экспериментов следует провести вымачивание электродов в специально приготовленных для этого растворах. Концентрация растворов и их состав указаны в методиках проведения отдельных ионометрических исследований. Растворы для вымачивания служат также для хранения электродов в перерывах между экспериментами, если есть необходимость поддерживать электроды в работоспособном состоянии. Если по каким либо причинам произошло высыхание мембран ИСЭ, вымачивание необходимо повторить.
При проведении измерений пару электродов (ИСЭ и электрод сравнения) необходимо погрузить в сосуд с исследуемым раствором. После этого, если необходимо, осуществляется термокомпенсация. Далее прибор следует перевести в режим измерения, выбрать необходимый диапазон показаний и подождать 1-2 минуты, чтобы показания прибора стали стабильными.. Пересчет показаний прибора в реальные значения концентрации осуществляется при помощи калибровочных графиков. Потребление ионов растениями оценивается по снижению, относительно контроля, концентрации раствора, который эти растения потребляли.
Ионометрические измерения можно проводить в сосудах разного размера, т.к. показания аппаратуры (в отличие от кондуктометрического метода) не зависят от геометрических показателей: объема сосуда, уровня жидкости, расстояния между электродами и т.д.
В то же время большое внимание следует уделять температуре исследуемых растворов и при необходимости проводить термокомпенсацию. Также после каждого измерения необходимо тщательно промывать в дистиллированной воде и протирать чистой фильтровальной бумагой погружаемые части электродов.
Поскольку зависимость показаний прибора от концентрации носит линейный характер, для калибровочного графика обычно бывает достаточно двух точек. Одной точке должна соответствовать концентрация раствора заведомо меньшая, а другой - заведомо большая, чем у исследуемого раствора. В силу того, что у отдельных элементов измерительной схемы (в первую очередь – у электродов) со временем наблюдается дрейф показаний, возникает необходимость в периодическом уточнении калибровочного графика
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 483; Нарушение авторских прав?; Мы поможем в написании вашей работы!