
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы и электродвижущие силы
|
|
|
|
Цепь проводников, включающая хотя бы один ионный проводник, называется гальванической. В разных звеньях гальванической цепи заряд переносится разными носителями – электронами или ионами.
Потенциометрия – совокупность физико-химических методов исследования, основанных на измерении ЭДС (электродвижущей силы) в гальванических цепях. Это быстрый и во многих случаях незаменимый метод определения физиологически активных ионов ( ) в биологической жидкости (крови, спинномозговой жидкости) или тканях организма.
) в биологической жидкости (крови, спинномозговой жидкости) или тканях организма.
Процесс возникновения скачка потенциала на границе раздела двух фаз.
Структура металла – система плотно упакованных сфер одинакового радиуса – положительных ионов. Атомы металла располагаются в кристаллической решетке на таком расстоянии, что их валентные электроны фактически связаны не с отдельным ядром, а делокализованы (обобщены) по всем атомам. Суммарный положительный заряд равен числу электронов и в обычном состоянии металл электронейтрален.
Растворение металла – переход катионов в раствор с поверхности электрода (пластинки металла) объясняется гидратацией катионов (Рис.4.). Катионы поверхности металла взаимодействуют с диполями воды. Возрастающая при этом теплота гидратации идет на разрыв связи ионов с кристаллической решеткой металла. Способность металла переходитьв раствор выражается тем сильнее, чем меньше потенциал ионизации и чем выше его  .
.

Обратный процесс – осаждение катионов металла из раствора на поверхность электрода. Процессы перехода катионов металлов в раствор (окисление) и осаждение (восстановление) идут одновременно. Через определенный промежуток времени наступает динамическое равновесие на
|
|
|
границе раздела твердой и жидкой фаз.
Рис.4 Образование двойного электрического
слоя на границе металл-раствор.
Ионы из-за электростатического взаимодействия с противоположно заряженной поверхностью электрода ориентируются вблизи поверхности раздела фаз. Образуется двойной электрический слой (ДЭС).
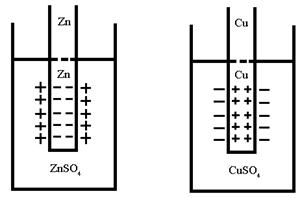


Рис. 5. Межфазный обмен электронами и электродные реакции.
Уравнение Нернста
Таким образом, на границе раздела двух фаз возникает разность потенциалов φ - гальвани-потенциал, величина которого зависит от природы контактирующих проводников. Величина φ определяется полезной работой самопроизвольного процесса, протекающего на границе раздела фаз: затрата химической работы компенсирована ростом скачка потенциалов Е (φ).
 ,
,
где n – число электронов электро-химического процесса, а φ – гальвани- потенциал.
 полуэлемент
полуэлемент
 для реакции:
для реакции:
По уравнению изотермы химической реакции:

Выражение (3.8) – Уравнение Нернста.
Методов прямого измерения гальвани-потенциалов не существует. Для этого используют электродный потенциал. С этой целью составляют гальванический элемент из изучаемого электрода и электрода сравнения, потенциал которого известен, практически постоянен и хорошо воспроизводится. В качестве электродов сравнения чаще всего используются водородный, хлорсеребряный, каломельный электроды. Электродвижущая сила, возникающая в созданном гальваническом элементе (ЭДС) позволяет определить электродный потенциал.
Ряд напряженностей металлов – значения стандартных электродных потенциалов по отношению к стандартному потенциалу водородного электрода, расположенных в определенной последовательности.
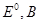
 ,
, 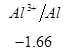 ,
,  ,
,  ,
, 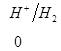 ,
, 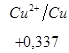 ,
, 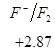
Гальванические элементы – химические источники электрического тока, позволяют получить работу за счет протекания химической реакции. Если из нескольких проводников (металлов растворов электролитов) составить цепь, то между концами такой правильно разомкнутой цепи возникает разность потенциалов Е (ЭДС), численно равная сумме всех скачков потенциалов на границах раздела фаз: 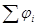 . ЭДС – разность потенциалов на концах разомкнутой цепи, когда во внешней цепи сила тока равна нулю. В этом случае система находится в состоянии равновесия и
. ЭДС – разность потенциалов на концах разомкнутой цепи, когда во внешней цепи сила тока равна нулю. В этом случае система находится в состоянии равновесия и 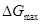 - максимально возможная работа по переносу единичного заряда вдоль замкнутой цепи. Единицы измерения ЭДС – вольты (В).
- максимально возможная работа по переносу единичного заряда вдоль замкнутой цепи. Единицы измерения ЭДС – вольты (В).
|
|
|
Условия работы гальванического элемента:
- пространственное разделение процессов;
- межфазный обмен электронами (то есть электродная реакция);
- протекание окислительно-восстановительной реакции по электрохимическому механизму.

Рис.6
 (3.9), где
(3.9), где
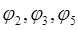 - контактные разности потенциалов, которыми можно пренебречь.
- контактные разности потенциалов, которыми можно пренебречь.
Устройство и работа гальванического элемента Якоби – Даниэля
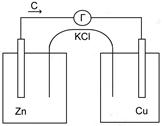
Рис.7 Устройство медно-цинкового гальванического элемента.
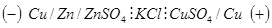
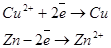

Гальванический элемент производит работу за счет окислительно-восстановительной реакции и поэтому его ЭДС, которая численно равна максимальной работе по перемещению заряда по замкнутой цепи, должна быть больше нуля. Из (3.9):
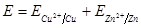
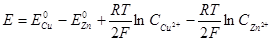


Классификация электродов
Электроды первого рода – металлы или неметаллы, погруженные в раствор, которые содержат их ионы с различной концентрацией.
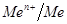
Реакция на границе металл-раствор: 
По уравнению Нернста: 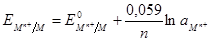 .
.
Электроды первого рода могут быть обратимыми как относительно катиона, так и относительно аниона: обратимость по катиону – электрод работает на основе обмена катионов между электродом и раствором (характерна для металлических электродов); обратимость по аниону – электрод работает на основе обмен анионов между электродом и раствором (характерна для неметаллических электродов и водородного). Иногда водородный электрод выделяют в газовые (инертный металл в контакте с раствором, содержащий ионы газообразного вещества, пропускаемого через раствор): водородный, хлорный, кислородный.
Рис. 8. Водородный электрод.
 1 – платинированная платина
1 – платинированная платина
2 – концентрированная серная кислота, омывается потоком водорода
|
|
|
Три состояния водорода:
а) молекулярный водород;
б)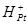 - молекулы водорода адсорбированные на поверхности
- молекулы водорода адсорбированные на поверхности
платины;
в) - ионы в растворе. Электродные реакции:
- ионы в растворе. Электродные реакции:

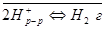
Суммарная реакция является каталитической и протекает на поверхности платины.
По уравнению Нернста:
 ,
,
где  - стандартный потенциал водородного электрода (нормальный).
- стандартный потенциал водородного электрода (нормальный).
При всех температурах, 
Электродный потенциал любого другого электрода можно определить как ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного. Водородный электрод обозначается в схеме слева.
Пример: Для определения электродного потенциала медного электрода:

С термодинамической точки зрения самопроизвольному процессу (убыль ( )) соответствует положительная ЭДС: то есть положительный потенциал у медного электрода и отрицательный у водородного. ЭДС этого элемента можно представить как следующую алгебраическую сумму:
)) соответствует положительная ЭДС: то есть положительный потенциал у медного электрода и отрицательный у водородного. ЭДС этого элемента можно представить как следующую алгебраическую сумму:
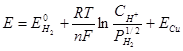 ,
,

 > 0.
> 0.
Для нахождения ЭДС цинкового электрода  (Е < 0):
(Е < 0):
 ,
,

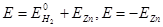 .
.
Электроды второго рода – это системы, в которых металл электрода покрыт слоем его малорастворимого соединения и погружен в раствор хорошо растворимой соли, содержащей тот же анион. Сюда относятся хлорсеребряный электрод и каломельный электрод.
Рис. 9 Х лорсеребряный электрод
 Серебряный электрод (1), часть поверхности которого электролитически покрыта слоем труднорастворимой соли AgCl (2), погружен в насыщенный раствор AgCl в хлориде KCl (3). На границе раздела металл - раствор протекает окислительно-восстановительная реакция:
Серебряный электрод (1), часть поверхности которого электролитически покрыта слоем труднорастворимой соли AgCl (2), погружен в насыщенный раствор AgCl в хлориде KCl (3). На границе раздела металл - раствор протекает окислительно-восстановительная реакция:

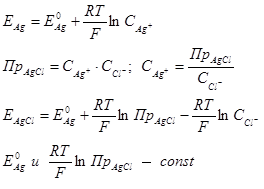 Потенциал такого электрода, согласно уравнению Нернста, определяется концентрацией катионов серебра в растворе:
Потенциал такого электрода, согласно уравнению Нернста, определяется концентрацией катионов серебра в растворе:
при данной температуре Т.
Следовательно,  стандартный потенциал хлорсеребряного электрода, то есть
стандартный потенциал хлорсеребряного электрода, то есть  определяется концентрацией ионов
определяется концентрацией ионов  в растворе. Потенциал хлорсеребряного электрода с насыщенным раствором KCl зависит только от температуры и рассчитывается по формуле:
в растворе. Потенциал хлорсеребряного электрода с насыщенным раствором KCl зависит только от температуры и рассчитывается по формуле:

Рис.10 Каломельный электрод:
 Ртуть покрыта пастой, которая содержит каломель
Ртуть покрыта пастой, которая содержит каломель –слаборастворимое соединение, в состав которого входит анион хлора; электрод помещен в раствор KCl.
–слаборастворимое соединение, в состав которого входит анион хлора; электрод помещен в раствор KCl.
|
|
|
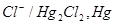
анод катод
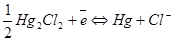
В зависимости от концентраций KCl, которая является постоянной, различают 1 Н; 0,1 Н; насыщенный каломельный электроды.
Электроды третьего рода – система, которая состоит из металла, который контактирует с двумя труднорастворимыми солями. В результате химической реакции менее растворимая соль превращается в более растворимую.
Свинцовый электрод
Находится в контакте с солями PbCl2 и AgCl.

Суммарная реакция:  .
.
Окислительно-восстановительные электроды – системы, в которых потенциало-образующие окислительно-восстановительные реакции идут без участия материала самого электрода (идет в растворе электролита без участия самого металла; электроды только осуществляют передачу электронов). Инертны.
Пример:  .
.
 .
.
Электрод «+» (катод), если будет идти реакция восстановления.
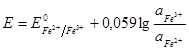
В ряду напряженностей металлов:  .
.
Электрохимические цепи
- Химические цепи состоят из электродов, потенциало-образующие химические реакции которых различны и определены равенством:
 .
.
Подобные цепи реализуются в первичных источниках тока – гальванических элементах, и во вторичных – аккумуляторах.
2. Концентрационные цепи состоят из электродов с одинаковыми потенциало-образующими реакциями, которые отличаются друг от друга активностью растворов. Могут образовываться при контакте двух растворов электролитов с различной активностью ионов, что обусловлено возникновением диффузионного потенциала на границе двух электролитов. В концентрационных электрохимических цепях используют один электролит, но различные электроды (например, амальгамные или газовые).
ЭДС концентрационного элемента позволяет определить некоторые физико-химические свойства растворов: активность, константу активности, числа переноса, растворимость.
Топливные генераторы – электрохимические генераторы, в которых происходит непрерывная подача вещества.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1104; Нарушение авторских прав?; Мы поможем в написании вашей работы!