
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рассмотрим, какие результаты дает применение теории активного комплекса к реакциям в растворах
|
|
|
|
А. Для бимолекулярных реакций в газовой фазе

Константа скорости в газовой фазе равна:
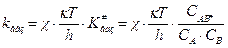
В растворе константа равновесия описывается следующим уравнением:
 ,
,
где a – активность, γ – коэффициент активности.
На основании этого константа скорости равна:

Сравнивая уравнения для 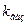 и
и  , можно увидеть, что они отличаются на величину, содержащую коэффициенты активности:
, можно увидеть, что они отличаются на величину, содержащую коэффициенты активности:
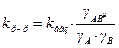
Чтобы оценить изменения К при переходе от газовой фазы к раствору, надо знать значения коэффициента активности. Уравнение для γ было получено Лэнгмюром:

где β – постоянная (для недиссоциирующих жидкостей примерно равна 5), ΔН – теплота испарения.
Тогда имеем:
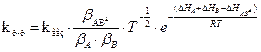
1) В зависимости от свойств активного комплекса будут те или иные расхождения между 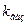 и
и  .
.
2) Величина энергии активации в газовой фазе и растворе не будут существенно отличатся.
3) Предэкспонентальный множитель в зависимости от значения 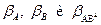 можно изменять в несколько раз.
можно изменять в несколько раз.
Б.Мономолекулярные реакции в растворах.
При переходе из газовой фазы в раствор кинетические характеристики мономолекулярной реакции не должны существенно изменятся. Теория активного комплекса позволяет это подтвердить:
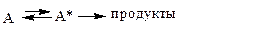
Так будет протекать мономолекулярная реакция согласно теории активного комплекса. Тогда выведенное ранее уравнение для константы скорости k реакции в растворе:
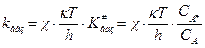

1) Не наблюдается существенных различий между 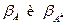 , между
, между  , поэтому мономолекулярные реакции меньше других будут зависеть от характера среды, в которой протекает процесс.
, поэтому мономолекулярные реакции меньше других будут зависеть от характера среды, в которой протекает процесс.
2) Различий между 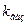 и
и  при переходе от газа к раствору меньше, чем у бимолекулярных реакций.
при переходе от газа к раствору меньше, чем у бимолекулярных реакций.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 356; Нарушение авторских прав?; Мы поможем в написании вашей работы!