
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация фермента и субстрата
|
|
|
|
РН
Умеренные изменения рН оказывают влияние на ионное состояние фермента и субстрата. Как показывают измерения ферментативной активности при различных рН, оптимум активности для разных ферментов находится в широких пределах рН.
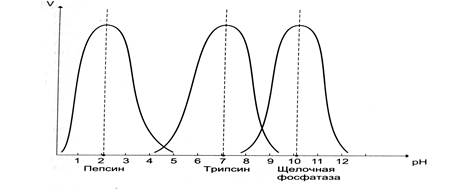
Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
| Фермент | Оптимальное значение рН |
| Пепсин | 1,5-2 |
| Каталаза | 6,8-7 |
| Уреаза | 6,8-7,2 |
| Трипсин | 6,5-7,5 |
| Аргиназа | 9,5-9,9 |
Зависимость активности от рН определяется следующими факторами.
1. денатурацией фермента при очень высоких или низких рН
2. изменением величины заряда молекул субстрата или фермента. Активность фермента может изменяться в результате изменений либо его структуры, либо заряда функциональных остатков, участвующих в катализе или связывании субстрата. Для примера рассмотрим взаимодействие «-» фермента (Е) с «+» субстратом (SH).
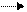 Е- + SH+
Е- + SH+ 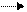 Е-SH
Е-SH
При низких рН происходит протонирование Е-
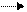 Е- + H+ ЕH
Е- + H+ ЕH
При высоких рН – депротонирование субстрата
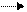 SH+ S + H+
SH+ S + H+
Поскольку взаимодействовать друг с другом могут только Е- и SH+, при крайних значениях рН эффективная концентрация Е- и SH+ будет низкой, что приведет к снижению скорости реакции. И только в области, выделенной двойной штриховкой, в нужном ионном состоянии находятся одновременно и Е, и S, а максимальной концентрации они достигают в точке Х.

Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента. Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например, в начальный период ферментативной реакции, т.к. в этот период не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции. Именно в этом случае начальная скорость реакции будет пропорциональна концентрации фермента. Фермент при взаимодействии с субстратом образует фермент-субстратный комплекс, который подвергается распаду на продукт и свободный фермент.
|
|
|
Если упростить это уравнение
то в уравнениях для скоростей прямой и обратной реакций обязательным компонентом является концентрация фермента
Однако в уравнениях для константы равновесия концентрация фермента не имеет значения
Как видно, константа равновесия ферментативной реакции не зависит от концентрации фермента.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 403; Нарушение авторских прав?; Мы поможем в написании вашей работы!