
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поверхность потенциальной энергии. Активный комплекс и координата реакции. Профиль пути реакции
|
|
|
|
Рассмотрим взаимодействие атома С с двухатомной молекулой АВ по реакции:
 АВ + С А + ВС
АВ + С А + ВС
По мере приближения исходного атома С к молекуле АВ вдоль прямой, соединяющей ядра атомов А и В, связь между атомами В и С усиливается, а между атомами А и В – ослабевает. На некотором расстоянии атома С от молекулы АВ возникает промежуточное состояние, при котором образуется так называемый активный комплекс А…В…С, который затем распадается с образованием конечных продуктов реакции – атома А и молекулы ВС.

| 
| 
|
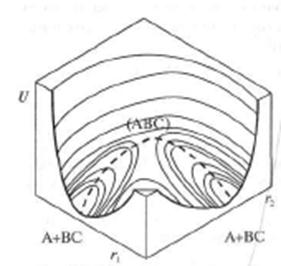 Поверхность потенциальной энергии
Поверхность потенциальной энергии
В процессе реакции изменяются расстояния между А – В и В – С и соответственно потенциальная энергия системы. Указанные изменения могут быть представлены трехмерной диаграммой. По оси Ох откладывают расстояние между атомами А и В ( ), по оси Оу – расстояние между атомами В и С (
), по оси Оу – расстояние между атомами В и С ( ) (при условии, что атомы А,В,С находятся на одной прямой – угол активированного комплекса А…В…С фиксирован и равен 180
) (при условии, что атомы А,В,С находятся на одной прямой – угол активированного комплекса А…В…С фиксирован и равен 180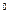 ), величина энергии откладывается по оси, перпендикулярной плоскости диаграммы. Трехмерную диаграмму можно заменить на двухмерную, тогда за изменением потенциальной энергии можно проследить по изоэнергетическим линиям (линии равной энергии) на поверхности потенциальной энергии, спроектированным на плоскость диаграммы.
), величина энергии откладывается по оси, перпендикулярной плоскости диаграммы. Трехмерную диаграмму можно заменить на двухмерную, тогда за изменением потенциальной энергии можно проследить по изоэнергетическим линиям (линии равной энергии) на поверхности потенциальной энергии, спроектированным на плоскость диаграммы.
Рис.1. Карта поверхности потенциальной энергии реакции  .
.
На диаграмме видно, что поверхность потенциальной энергии будет иметь две долины:  - в которой система АВ+С находится до реакции и
- в которой система АВ+С находится до реакции и 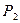 - в которой находится система А+ВС, возникшая в результате реакции. Для перехода от
- в которой находится система А+ВС, возникшая в результате реакции. Для перехода от  к
к 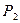 система должна преодолеть энергетический барьер, разделяющий обе долины. Для такого перехода существует наиболее короткий, выгодный энергетический путь, проходящий по ложбине через точку перевала Р. Когда атом С далеко от молекулы АВ (верхний угол диаграммы), потенциальная энергия системы описывается кривой в верхней части диаграммы. По мере сближения атомов В и С связь А – В ослабевает, т.к. увеличивается
система должна преодолеть энергетический барьер, разделяющий обе долины. Для такого перехода существует наиболее короткий, выгодный энергетический путь, проходящий по ложбине через точку перевала Р. Когда атом С далеко от молекулы АВ (верхний угол диаграммы), потенциальная энергия системы описывается кривой в верхней части диаграммы. По мере сближения атомов В и С связь А – В ослабевает, т.к. увеличивается  и начинает возникать новая связь В – С. Потенциальная энергия системы при этом растет и в некоторой точке Р достигает максимума. В этом состоянии (в точке Р) молекулы АВ и ВС отдельно не существуют, атом В в одинаковой степени принадлежит молекулам АВ и ВС. Такое состояние получило название активного комплекса или переходного состояния. При дальнейшем сближении атомов В и С связь В – С усиливается, атом А отделяется от атома В, потенциальная энергия системы уменьшается, система переходит в конечное состояние, образуется атом А и устойчивая молекула ВС, потенциальная энергия которой изображена на диаграмме справа. Из диаграммы видно, что наиболее вероятное состояние системы проходит по энергетической «ложбине» через точку перевала и по другой «ложбине» скатывается к конечному состоянию. Эта совокупность наиболее вероятных состояний системы носит название пути реакции или координаты реакции (пунктирная линия). Активный комплекс как бы скатывается по энергетической ложбине вдоль пути реакции и при этом одновременно находится на вершине потенциального барьера. Разность между потенциальной энергией исходных веществ в долине
и начинает возникать новая связь В – С. Потенциальная энергия системы при этом растет и в некоторой точке Р достигает максимума. В этом состоянии (в точке Р) молекулы АВ и ВС отдельно не существуют, атом В в одинаковой степени принадлежит молекулам АВ и ВС. Такое состояние получило название активного комплекса или переходного состояния. При дальнейшем сближении атомов В и С связь В – С усиливается, атом А отделяется от атома В, потенциальная энергия системы уменьшается, система переходит в конечное состояние, образуется атом А и устойчивая молекула ВС, потенциальная энергия которой изображена на диаграмме справа. Из диаграммы видно, что наиболее вероятное состояние системы проходит по энергетической «ложбине» через точку перевала и по другой «ложбине» скатывается к конечному состоянию. Эта совокупность наиболее вероятных состояний системы носит название пути реакции или координаты реакции (пунктирная линия). Активный комплекс как бы скатывается по энергетической ложбине вдоль пути реакции и при этом одновременно находится на вершине потенциального барьера. Разность между потенциальной энергией исходных веществ в долине  и потенциальной энергией активного комплекса в перевальной точке Р равна энергии активации, обладая которой молекулы исходных веществ в состоянии преодолеть потенциальный барьер и перейти в конечные продукты реакции.
и потенциальной энергией активного комплекса в перевальной точке Р равна энергии активации, обладая которой молекулы исходных веществ в состоянии преодолеть потенциальный барьер и перейти в конечные продукты реакции.
|
|
|
Построить поверхность потенциальной энергии сложно, поэтому строят профиль пути реакции. Если сделать разрез потенциальной поверхности, перпендикулярный плоскости диаграммы и проходящий вдоль пути реакции, а затем развернуть поверхность разреза в одну плоскость, то получим кривую, представляющую собой профиль пути реакции.
|
|
|
Построимпрофиль пути реакции, который будет представлять собой изменение потенциальной энергии от координаты реакции 

Видно, что:
1. Реагирующая система прежде, чем перейти к конечному состоянию, должна преодолеть потенциальный барьер, равный Е - классической энергии активации.
- классической энергии активации.
2. Разность между потенциальными энергиями исходных веществ и продуктов реакции – это тепловой эффект реакции -  .
.
3. Более точное рассмотрение показывает: любая система атомов ни при каких условиях, даже при температуре абсолютного нуля, не может обладать энергией меньшей некоторой величины – нулевой энергии.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2791; Нарушение авторских прав?; Мы поможем в написании вашей работы!