
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение скорости мономолекулярной реакции
|
|
|
|
Уравнение для концентрации активных частиц

Активные молекулы А* имеют среднее время жизни 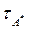 , обусловленное вероятностью превращения А* в продукты:
, обусловленное вероятностью превращения А* в продукты:
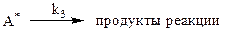
| (3) |
Чем ниже 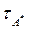 , тем выше
, тем выше 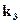 ;
;
Время между столкновениями частиц А* и А характеризуется 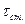 :
:
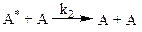 (реакция дезактивации)
(реакция дезактивации)
| (2) |
Чем ниже 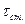 , тем выше
, тем выше 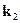 .
.
В зависимости от соотношения 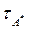 и
и 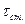 уравнение для скорости имеет две формы.
уравнение для скорости имеет две формы.
1) При высоких давлениях: усиливаются столкновения между частицами, все молекулы А* дезактивируются, не успевая распадаться на продукты,
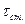 <<
<< 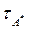
Тогда в уравнении для скорости 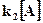 >>
>>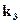
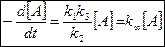
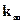 - предельная константа скорости при больших давлениях (Р), когда
- предельная константа скорости при больших давлениях (Р), когда 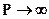 .
.
Таким образом, при высоких давлениях мономолекулярная реакция является реакцией I порядка.
2) При низких давлениях: время между столкновениями возрастает и может превысить время жизни А*, тогда большинство из них, не успевая дезактивироваться, распадаются на продукты:
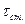 >>
>> 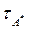 ;
;
Тогда в уравнении для скорости 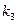 >>
>>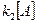
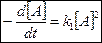
Таким образом, при низких давлениях мономолекулярная реакция протекает как реакция II порядка.
Следствия из теоретической схемы Линдемана:
1. Активация для мономолекулярных реакций является результатом соударений, то есть бимолекулярным процессом. Скорость реакции пропорциональна не числу столкновений, а доле А* активных молекул.
Скорость реакции пропорциональна не числу столкновений, а доле А* активных молекул.

2. При высоких давлениях усиливаются столкновения, большинство активных молекул дезактивируются, при этом выполняется кинетическое уравнение I порядка. При понижении давления время между столкновениями возрастает до величины большей, чем время жизни А*, большинство активных молекул распадаются на продукты и реакция переходит в реакцию II порядка.
Схема Линдемана дает аналитическую зависимость k от Р, позволяя рассчитать 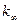 при
при 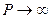 .
.
|
|
|
Скорость мономолекулярной реакции, определяемая из опыта:
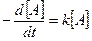
k – константа скорости реакции, определенная экспериментальным путем.
Сравнивая уравнения:
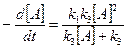 ,
,
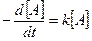
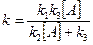
или
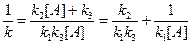
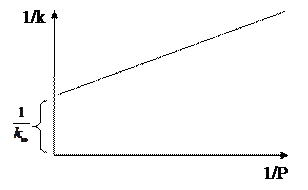
Обозначим: [A] = P/RT (из уравнения Клайперона-Менделеева νRT=PV; C VRT= PV; C = PV/RTV = P/RT); k2/k1k3 = 1/ 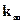 , тогда
, тогда
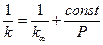
Из зависимости 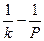 можно найти значение
можно найти значение 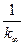 , то есть предельную константу скорости
, то есть предельную константу скорости 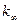 при больших Р.
при больших Р.
3. Действие добавок, приводящих реакцию к мономолекулярной при низких Р, объясняется тем, что молекулы добавленного вещества, сталкиваясь с возбужденными молекулами, дезактивируют их, а сталкиваясь с невозбужденными молекулами, активируют их. Роль добавляемых молекул заключается в поддержании равновесной (по распределению Максвела-Больцмана) концентрации активных частиц. Доля участия молекулы в переносе энергии при мономолекулярном распаде возрастает с ростом молекулярного веса и числа атомов в молекуле.
Выведем уравнение для скорости активации мономолекулярной реакции по теории столкновений.
А + А → А* + А
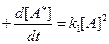 - согласно Линдеману
- согласно Линдеману
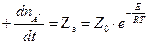 - по теории активных столкновений,
- по теории активных столкновений,
где n – число активных частиц,
Z0 – число активных столкновений.
В данном процессе продукты реакции не образуются, поскольку это процесс активации, поэтому стерический множитель в уравнении отсутствует.
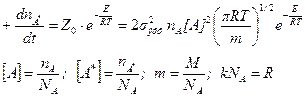
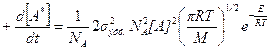
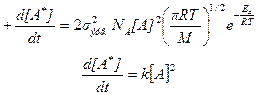
Уравнение выведено без учета внутренних колебательных степеней свободы молекулы, то есть считается, что вся энергия сталкивающихся частиц является кинетической энергией их поступательного движения.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1143; Нарушение авторских прав?; Мы поможем в написании вашей работы!