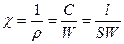КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Удельная и эквивалентная электропроводность. Зависимость от концентрации электролита
|
|
|
|
Электропроводность К раствора – это величина, обратная его сопротивлению R:
 ;
; 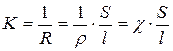 [
[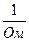 ]
]
где ρ – удельное сопротивление; S – площадь электродов; l – расстояние между электродами; χ – удельная электропроводность (величина обратная ρ).
Электропроводность характеризует способность растворов электролитов проводить электрический ток за счет ионов, образующих при диссоциации электролитов. **** Величина К зависит от С, Т, природы растворителя и электролита.
Различают несколько видов электропроводности.
Удельная электропроводность ( χ ) – это электропроводность одного 1 см3 раствора, находящегося между электродами параллельными, расположенными на расстоянии 1 см друг от друга.



 [Ом-1·м-1], [Ом-1·см-1]
[Ом-1·м-1], [Ом-1·см-1]
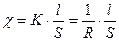 ;
; 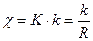
где R – измеряют экспериментально;
 (размерность м-1) – константа ячейки, определяется экспериментально путем измерения К раствора с точно известным χ (раствора KCl определенной концентрации).
(размерность м-1) – константа ячейки, определяется экспериментально путем измерения К раствора с точно известным χ (раствора KCl определенной концентрации).
Величина 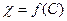 зависит от концентрации электролита. Зависимость имеет экспериментальный характер.
зависит от концентрации электролита. Зависимость имеет экспериментальный характер.

| Сильные электролиты | Слабые электролиты |
| 1. Зависимость сильно выражена. 2. С увеличением С величина χ увеличивается за счет увеличения количества ионов в растворе. 3. Дальнейшее увеличение С приводит к уменьшению χ за счет уменьшения скорости движения ионов вследствие их большого количества и межионного взаимодействия. | 1. Зависимость слабо выражена. 2. С увеличением С величина χ увеличивается за счет увеличения количества ионов в растворе. 3. Дальнейшее увеличение С приводит к уменьшению χ за счет того, что с ростом С α падает и количество ионов уменьшается. |
 Величина
Величина  зависит от Т: повышение температуры на 1 К увеличивает χ примерно на 2 – 2,5 %. Это объясняется для сильных электролитов – понижением вязкости раствора, уменьшением сольватации ионов, а для слабых увеличением степени их диссоциации.
зависит от Т: повышение температуры на 1 К увеличивает χ примерно на 2 – 2,5 %. Это объясняется для сильных электролитов – понижением вязкости раствора, уменьшением сольватации ионов, а для слабых увеличением степени их диссоциации.
|
|
|
Эквивалентная электропроводность α – это электропроводность объема раствора, содержащего 1 г-экв электролита, и находящегося между параллельными электродами, расположенными на расстоянии 1 см друг от друга.
 [
[ ]
]
где – С эквивалентная (нормальная концентрация), г·экв/л;
 - разведение (или разбавление) раствора – это объем, в котором содержится 1 г-экв электролита (л/г-экв.).
- разведение (или разбавление) раствора – это объем, в котором содержится 1 г-экв электролита (л/г-экв.).
Величина λ с ростом С падает, что связано для сильных электролитов – с увеличением межионного взаимодействия и снижения скорости движения ионов, а для слабых – с уменьшением α электролитов и уменьшением количества ионов.
Величина λ возрастает с ростом разбавления раствора (V) и при бесконечном разведении (С→0)
асимптотически приближается к предельному значению  λ0.
λ0.
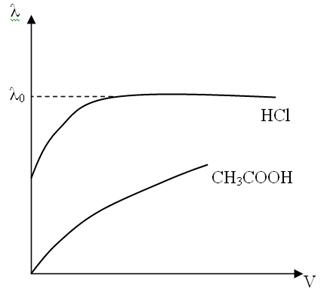 λ0 – предельная эквивалентная электропроводность раствора при бесконечном разведении, соответствующим отсутствию межионного взаимодействия. Для слабых электролитов λ0 экспериментально не достигается.
λ0 – предельная эквивалентная электропроводность раствора при бесконечном разведении, соответствующим отсутствию межионного взаимодействия. Для слабых электролитов λ0 экспериментально не достигается.
Для разбавленных растворов сильных электролитов зависимость α от С описывается эмпирической формулой (уравнением) Кольра-уша:

 где λ от λ0 – эквивалентная электропроводность раствора при концентрации С и при бесконечном разведении; А – константа при данной Т для данного электролита и растворителя.
где λ от λ0 – эквивалентная электропроводность раствора при концентрации С и при бесконечном разведении; А – константа при данной Т для данного электролита и растворителя.
Строя график зависимости λ от 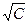 и экстраполируя ее на С = 0, по отрезку на оси Оу определяем величину λ0. Для слабых электролитов формула Кольрауша не выполняется, зависимость нелинейная.
и экстраполируя ее на С = 0, по отрезку на оси Оу определяем величину λ0. Для слабых электролитов формула Кольрауша не выполняется, зависимость нелинейная.
Методы измерения удельной электропроводности χ.
Измерение удельной электропроводности проводят на приборе, который называется мостиком Уитстона с применением переменного тока.
|
|
|
1. Описание установки.
Прибор представляет собой контур АВС.
 Между В и С в цепь включен сосуд с исследуемым раствором, для которого мы будем измерять электропроводность.
Между В и С в цепь включен сосуд с исследуемым раствором, для которого мы будем измерять электропроводность.
Поскольку электропроводность это величина обратная сопротивлению, то необходимо измерить, прежде всего, сопротивление W исследуемого раствора. Для этого между А и С в цепь включают магазин сопротивления R (с помощью магазина можно точно установить сопротивление).
Отрезок АВ – тонкая однородная металлическая (Pt, Mn) проволока, натянутая на линейку. В точках А и В подсоединяются провода, по которым подается переменный ток от генератора звуковой частоты v (от 16 до 20000 Гц). Переменный ток применяется во избежание поляризации электродов (это явление изменения концентрации электролита возле электродов, т. е. когда ионы одного знака скапливаются возле электродов. Это может привести к изменению сопротивления раствора электролита и исказить результаты). Наличие переменного тока фиксируют низкоомным телефоном, который включают между точкой С и подвижным контактом d (который можно двигать по проволоке).
2. Принцип метода.
Константу d будем двигать вдоль проволоки до тех пор, пока в телефонной трубке не будет слышно звука. Отсутствие звука будет означать, что сопротивление в магазине R равно сопротивлению исследуемого раствора W и переменный ток звуковой частоты отсутствует. При таком положении контакта d и будем измерять сопротивление исследуемого раствора электролита.
Согласно закону Кирхгофа сопротивления R, W, r1 и r2 связаны соотношением:

Поскольку проволока однородная, то отношение сопротивлений r1 и r2 равно отношению отрезков, на которых эти сопротивления наблюдаются:

где Ad, dB – определяются по линейке;
R – точно выставлено на магазине сопротивления.
Известно, что сопротивление раствора равно:
 или
или  ;
;  ;
;
где  - емкость сопротивления сосуда;
- емкость сопротивления сосуда;
l – расстояние между электродами;
S – площадь электродов.
Тогда удельная электропроводность равна:
|
2. Подвижность ионов. Закон Кольрауша.
Электропроводность электролитов при заданной С определяется скоростью движения их ионов в электрическом поле.
Выведем формулу зависимости λ от подвижности ионов.
|
|
|
Пусть есть электролитический цилиндр с поперечным сечением q в котором электроды расположены на расстоянии l. Подсчитаем число ионов проходящих через это сечение и определим I и, соответственно, электропроводность, которую они обуславливают.
Пусть v+ (см/сек) – скорость движения катиона;
 v- (см/сек) – скорость движения анионов;
v- (см/сек) – скорость движения анионов;
Сi – (г·экв/см3) – эквивалентная концентра- ция ионов;
q (см2) – поперечное сечение цилиндричес-кого сосуда;
l (см) – расстояние между электродами;
Е (В) – разность потенциалов между электродами;
Eλ – напряженность поля – это разность потенциалов между электродами, находящихся на расстояние 1 см друг от друга. При стандартных условиях Eλ= 1 В/см.
Общее количество электричества (или сила тока) I, проходящее через раствор за 1 сек равно сумме:

I+ и I- - количество электричества, перенесенного катионами и анионами.
Число ионов, которое переносит данное количество электричества через поперечное сечение q за 1 сек, равно:
 ;
; 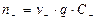 ;
;
где n-, n+ - число катионов и анионов.
Т. к. каждый г·экв ионов несет, согласно закону Фарадея F=96485 Кл электричества, то сила тока, обусловленная катионами и анионами равна:
 ;
;
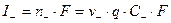 ;
;

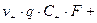
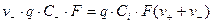
Скорость движения ионов прямо пропорциональна напряженности электрического поля:
 ;
; 
где v0+, v0- - абсолютные подвижности катиона и аниона, которые равны их скоростям при  В/см2; [см2/В·С]. Подставим значения v+ и v- в уравнение для I:
В/см2; [см2/В·С]. Подставим значения v+ и v- в уравнение для I:
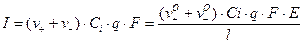
Согласно закону Ома:
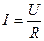 ;
;  ;
; 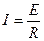 ;
;  ;
;  ;
;
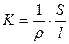 ;
;  ;
; 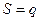 ;
; 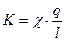 ;
;
 ;
;  ;
;  ;
;
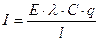 ;
;


Для сильных электролитов: 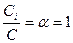
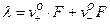
Для слабых электролитов: 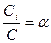

Введем обозначения:
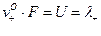 [
[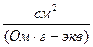 ]
]
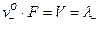
V (λ+), V (λ-) – подвижности (или электрические подвижности) катиона и аниона.
Тогда получаем:
для сильных электролитов: 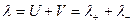
для слабых электролитов: 
Подвижности ионов при бесконечном разведении называется предельными подвижностями, и обозначаются как U0(λ0+) V0 (λ0-).
Тогда и для сильных и для слабых электролитов будем иметь:
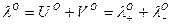
закон Кольрауша
Согласно закону Кольрауша: эквивалентная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов.
|
|
|
Величины λ0i являются справочными данными.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 12203; Нарушение авторских прав?; Мы поможем в написании вашей работы!