
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчеты в гравиметрическом методе. Расчет исходной навески
 |
В результате обобщения многочисленных исследований было рекомендовано задавать оптимальную массу гравиметрической формы для объемных аморфных осадков порядка 0,1 г, для кристаллических осадков — от 0,1 до 0,5 г, для легких осадков — от 0,1 до 0,2 г, для тяжелых — 0,4-0,5 г. Зная требуемую массу гравиметрической формы, ее состав и примерное содержание определяемого элемента в исходной пробе, можно рассчитать массу исходной навески в каждом конкретном случае.
Расчет массы исходной навески при гравиметрическом определении железа 3-валентного в хлориде железа:
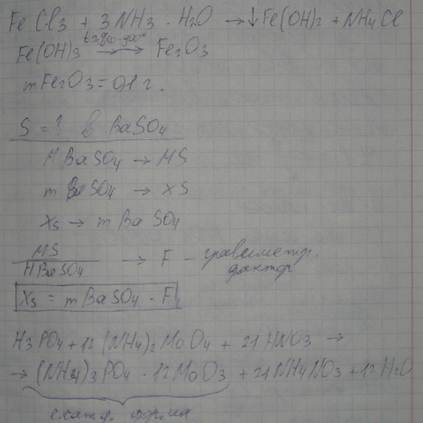
При вычислении гравиметрического фактора следует учитывать стехиометрические коэффициенты.
Объемные методы анализа — заключаются в точном определении объема титранта с точно известной концентрацией, затраченного при определении точки эквивалентности (момент, при котором количество прибавленного титрованного раствора эквивалентно количеству определяемого вещества).
Точка эквивалентности может быть определена по изменению окраски или по изменению физико-химических свойств системы. В металлургии широко используют метод перманганатометрии, метод трилонометрии, метод иодометрии, метод аргентометрии, метод нейтрализации.
В отличие от весового анализа, в объемном анализе измеряют объем реактива известной концентрации в эквивалентных количествах прореагировавший с определяемым веществом.
Преимущества объемного анализа: быстрота определения и возможность применения большого количества реакций. Недостаток — меньшая точность, но достаточная для производственных и исследовательских целей. Широко применим на практике.
|
|
|
Требования к реакциям в объемном анализе:
1) реакция должна быть необратима;
2) реакция должна проходить мгновенно;
3) вещества, вступающие в реакцию, должны взаимодействовать в эквивалентных количествах;
4) изменение условий проведения реакций не должно влиять на ход реакций и не должно изменять состав продукта.
Пример использования химических методов в металлургии: определение фосфора в железных и марганцевых рудах. Мелкоизмельченную руду в количестве 2-3 г помещают в глубокую фарфоровую чашку (10-12 см в диаметре) и растворяют при нагревании на водяной или песчаной бане в 30-40 мл соляной кислоты (HCl). В момент растворения чашку накрывают часовым стеклом. После растворения навески осторожно прибавляют 3-5 мл азотной кислоты и продолжают нагревать раствор, одновременно упаривая его досуха. Сухой остаток выдерживают в сушильном шкафу или в специальном штативе при температуре 120-130 градусов в течение 30-40 минут. Охладив чашку, растворяют ее содержимое в 15 мл соляной кислоты и 75 мл воды при нагревании на песчаной бане. Образовавшийся осадок отфильтровывают и промывают 5-6 раз горячей водой. К фильтрату приливают 25 мл азотной кислоты и упаривают до объема 10-15 мл. К выпаренному раствору приливают еще 20 мл азотной кислоты и вторично выпаривают его до 5-10 мл. Затем в чашку наливают 30 мл азотно-кислого аммония, нейтрализуют его при помощи 25-процентного раствора чего-то там до появления незначительного нерастворимого осадка гидратов железа и других примесей. Этот осадок растворяют, приливая 5 мл азотной кислоты; полученный прозрачный раствор руды нагревают в чашке до 50-60 градусов. В отдельном стакане (400 мл) нагревают до 60-75 градусов; плюс 80 мл молибденово-кислого аммония и раствор руды. Остаток в чашке смывают водой. После этого приливают еще какую-то хуету и мешают, блять. Ставят в теплое место на 2-3 часа для выпадения более крупного осадка. При этом образуется желтый осадок по какой-то охуенной реакции.
|
|
|
Весовое определение фосфора. Высушенный в течение 30-40 минут... помещают в больший форфоровый тигель, устанавливают его в форфоровом треугольнике и прокаливают на небольшом пламени горелки до красного коления внешнего тигеля (до тех пор, пока желтый осадок не примет темно-синий цвет). Охладив тигель, взвешиваем его. Содержание фосфора рассчитывается по формуле:

Объемный (щелочной) метод определения фосфора. Желтый осадок фосфоро-молибденово-кислого аммония фильтруют через бумажный фильтр, содержащий мацирированную бумажную массу, промывают сначала 1-процентной азотной кислотой (до полного удаления следов железа), затем — 5-8 раз 1-процентным KNO3 (до полного удаления из осадка азотной кислоты). Промытый осадок вместе с фильтром помещают в колбу на 300-350 мл, приливают 15-20 мл титрованного раствора NaOH; закрыв колбу, встряхивают ее до исчезновения желтого осадка. Вывернув пробку, тщательно ополаскивают ее над колбой, одновременно полощат стенки колбы и затем приливают 5-10 капель фенол-фталеина и сразу же титруют избыток NaOH азотной кислотой (до исчезновения розовой окраски). Процент фосфора рассчитывают по формуле:

Физико-химические методы анализа — отличаются высокой чувствительностью, скоростью выполнения и точностью. Чем меньшее количество вещества определяется данным методом, тем выше его чувствительность. Относятся к физико-химическим методам: электрохимические методы, фотометрические методы, оптические методы, спектральные методы, резонансные методы и др.
Электрохимические методы основываются на процессах, протекающих на электродах или в межэлектродном пространстве. Электродные процессы могут происходить как при отсутствии внешнего электрического тока, так и при наложении напряжении напряжения от источника постоянного тока. При этом электрические параметры химической системы (электродный потенциал, сила тока, электрическое сопротивление) зависят от природы вещества и концентрации определяемого компонента. В металлургии из электрохимических методов наиболее часто применяются: амперометрический метод, потенциометрия, полярография, кулонометрия, электрогравиметрия (выделение на электродах различных веществ на электродах при электролизе).
|
|
|
1) Амперометрический метод анализа — основан на скачкообразном изменении тока, протекающим через реакционную ячейку во время титрования при достижении точки эквивалентности. Если в сосуд, где происходит химическая реакция и производится химическое титрование, погрузить два электрода из благородных металлов (чаще всего платина) и соединить их с источником постоянного тока через м-амперметр, то в момент эквивалентности происходит скачкообразное изменение тока, протекающего через сосуд.
Достоинство амперометрического метода — возможность определения момента эквивалентности, когда это невозможно сделать никаким другим способом.
Принципиальная схема установки для амперометрического титрования:
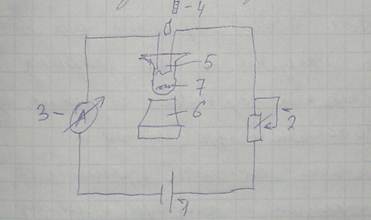
Порядок определения: в реакционную ячейку 5 наливается испытуемый раствор (точный объем); ячейку устанавливают на электромагнитную мешалку 6, на дно ячейки помещается якорек 7. Бюретка 4 заполняется рабочим раствором и устанавливается над ячейкой. В ячейку опускаются платиновые электроды. Подается напряжение от источника 1. С помощью переменного сопротивления 2 стрелку амперметра 3 устанавливают в среднее положение. Начинают титрование — медленно, при постоянном перемешивании добавляют рабочий раствор в ячейку. При достижении точки эквивалентности амперметр 3 покажет скачок тока (стрелка резко куда-нибудь ебанет). Процентную концентрацию определяемого вещества находят по калибровочному графику, который строят заранее по стандартным образцам.
2) Потенциометрический метод анализа — основан на измерении разности потенциалов электродов или ЭДС, зависящих от концентрации и природы анализируемого вещества. Зависимость потенциала электрода выражается уравнением Нэрнста:

Если в раствор, содержащий анализируемое вещество, опустить электрод из благородного металла (платина, золото), то электрод приобретет потенциал, характерный для данного элемента. Это объясняется тем, что ионы, находящиеся в растворе анализируемого вещества, попадая на электрод, способны принять или отдать ему электроны; при этом на поверхности электрода создается двойной электрический слой, и электрод заряжается положительно или отрицательно. Величина и знак потенциала определяется концентрацией и природой анализируемого вещества, но этот потенциал сам по себе измерить практически невозможно. Если в этот же раствор опустить еще один электрод из другого благородного металла, то он также приобретет заряд, но обязательно иной. Если их затем соединить между собой в электроцепь, то тогда становится возможным измерить эти ебаные потенциалы. Один из электродов называется измерительным (основным), другой — электродом сравнения (вспомогательным).
|
|
|
Основные электроды — это: 1) металлические первого рода (пластина или проволока из металла, погруженная в раствор соли этого же металла); 2) амальгамные (редокс-электроды) — служат для определения окислительно-восстановительного потенциала системы (золото, серебро, платина, иридий, уголь).
Вспомогательные электроды — выполняются из металла, покрытого слоем малорастворимого соединения этого же металла и погруженного в раствор хорошо растворимого соединения с тем же анионом.
Потенциометрия широко применяется для измерения активности водородных ионов. Свойство любого водного раствора можно выразить в функции концентрации водородных ионов в этом растворе. Дистиллированная вода обладает наибольшей диэлектрической проницаемостью. Это способствует диссоциации растворяемого в ней вещества на ионы. Сама вода распадает на ионы крайне незначительно, и концентрацию водородных ионов в ней можно считать постоянной. На практике концентрацию водородных ионов численно характеризуют отрицательным логорифмом концентрации (водородный показатель pH); вот это вот можно рассчитать через константу диссоциации воды.

Для измерения pH используется электрод из специального литиевого стекла, при погружении которого в раствор происходит обмен ионами, и ионы лития замещаются на ионы водорода. Стеклянный электрод приобретает положительный потенциал, который зависит от концентрации водородных ионов в анализируемом растворе.
Потенциометрический метод имеет ряд преимуществ перед обычным титрованием:
1) можно проводить в мутных и окрашенных растворах;
2) легко автоматизировать.
Принципиальная схема измерительной системы для потенциометрического титрования:
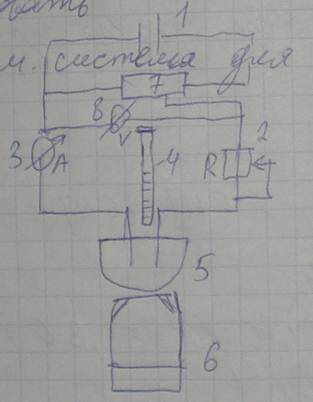
1 — источник питания; 2 — переменное сопротивление; 3 — амперметр; 4 — бюретка титровальная; 5 — ячейка с анализируемым раствором и электродами; 6 — электромагнитная мешалка; 7 — потенциометр (позволяет менять напряжение, подаваемое на электроды); 8 — вольтметр (фиксирует точку эквивалентности).
Пример: определение граммового содержания хрома в растворе методом потенциометрии.
3) Полярографический метод анализа — основан на явлении концентрационной поляризации на капельном ртутном электроде, возникающей при прохождении электрического тока через химический раствор.
Принципиальная схема измерительной системы для полярографического метода:
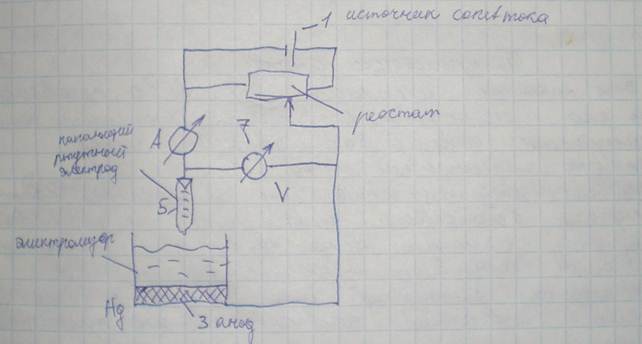
1 — источник постоянного тока; 2 — реостат (служит для измерения напряжения); 3 — анод; 4 — электролизер (рабочая ячейка); 5 — капающий ртутный электрод; 6 — амперметр; 7 — вольтметр.
Положительный полюс источника постоянного тока 1 соединен через реостат 2 с анодом 3; отрицательный полюс источника 1 через амперметр 6 соединен с ртутным электродом 5.
В систему подается напряжение от источника 1 и постоянно наращивается. Во время анализа непрерывно измеряют и записывают величину тока в зависимости от изменения напряжения. По данным строят полярограмму (ВАХ). Вид ВАХ — полярографическая волна. Если в растворе присутствует один определяемый элемент, получается одна поляграфическая волна; если несколько — последовательно несколько волн.
Качественный полярографический анализ основывается на измерении потенциала полуволны (потенциал середины поляграфической волны). Определив потенциалы полуволн ионов элементов, находящихся в растворе, по справочным таблицам можно установить данные элементы. Потенциал полуволны для каждого элемента индивидуален.
Количественный поляграфический анализ производится путем измерения высоты поляграфической волны на графике или диаграмме. Полярографическая волна фиксируется на диаграммной ленте пишущего устройства. Это позволяет определить ее высоту и — по высоте — количество определяемого элемента.
Основное достоинство полярографии — позволяет определять практически все элементы таблицы Менделеева. Недостаток — необходимость работы с ртутью и медленность анализа.
4) Кулонометрический метод анализа — определяем количество электричества, которое расходуется в ходе электрохимической реакции. Различают два основных метода:
— прямая кулонометрия;
— кулонометрическое титрование.
В методах прямой кулонометрии анализируемое вещество непосредственно подвергается электрохимическому превращению.
В методе кулонометрического титрования определяемое вещество реагирует с титрантом, который получается в кулонометрической ячейке при электролизе специально подобранного раствора. Количество израсходованного на титрование реагента определяют по количеству электричества, прошедшего через раствор, в котором этот реагент генерируется за счет электролиза, то есть при прохождении электрического тока через раствор происходит разложение или восстановление какого-либо вещества, участвующего в реакции. Электроды, участвующие в разложении вещества, — генераторные. Электроды, фиксирующие изменения тока, — индикаторные.
Таким образом, прибор для кулонометрического титрования должен включать в себя две цепи — генераторную и индикаторную. Генераторная цепь состоит из генерационной ячейки, источника постоянного тока, прибора для определения количества электричества, прошедшего через ячейку, генераторных электродов. Индикаторная цепь: устройство, позволяющее определить конец кулонометрического титрования, электродная система, состоящая из основного и вспомогательного электрода. В металлургическом производстве из приборов, в которых используются кулонометрические и потенциометрические методы измерения, достаточно широко используется экспресс-анализатор на углерод АН-7529.
Принципиальная схема АН-7529:
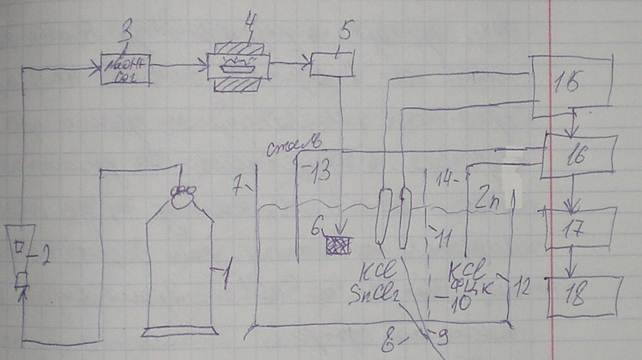
В анализаторе применен метод автоматического кулонометрического титрования по величине pH. Навеска стали, помещенная в фарфоровую лодочку, сжигается в трубчатой печи 4 в потоке очищенного от примесей кислорода, подаваемого из баллона 1 через ротаметр-дозатор 2 и фильтр 3. Фильтр заполняется NaOH для поглощения CO2. Образовавшийся при сгорании стали углекислый газ, проходя через фильтр 5, очищается от параллельно образующихся окислов железа, кремния, марганца и прочих продуктов горения. Очищенный CO2 уносится потоком кислорода в электролитическую ячейку 7, где поглощается поглотительным раствором 8, состоящим из KaCl и SnCl2. Происходит закисление раствора:
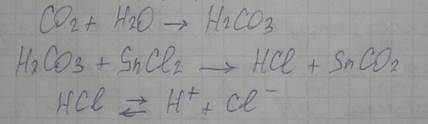
Это фиксируется индикаторными электродами 9 и 10, и информация передается на pH-метр 15, что приводит к изменению выходного напряжения его высокоомного усилителя; затем данное напряжение в преобразователе 16 преобразуется в импульсы напряжения с длительностью, пропорциональной значению полученного напряжения. Импульсы напряжения стабилизатором 17 преобразуются в импульсы тока, которые направляются на электроды генераторной цепи, которая состоит из анода 14 (цинковая пластина) и катода 13 (нержавеющая сталь). Анод генераторной цепи изолирован токопроницаемой перегородкой. При протекании тока на цинковом аноде 14 образуются ионы цинка, взаимодействующие со вспомогательным раствором, содержащим KaCl и ферроцианид калия (ФЦК). Импульсы тока вызывают восстановление ионов водорода на катоде 13, нейтрализуя кислоту, образующуюся при поглощении углекислого газа. Количество электричества, потребовавшегося для нейтрализации, фиксируется пересчетным индикаторным устройством 18, отградуированным в процентах массовой доли углерода.
5) Электрогравиметрия — это, короче, электролиз.
6) Фотометрический, калориметрический и электрофотокалориметрический метод. Калориметрическое определение элементов основано на использовании таких химических реакций, в результате которых происходит изменение окраски анализируемого раствора. Измеряя интенсивность полученной окраски, можно судить о количественном составе, содержании окрашенного вещества в растворе. Чем больше содержание окрашенного продукта, тем интенсивнее окраска раствора. Если концентрация окрашенного вещества постоянна, то степень окраски раствора зависит от толщины светопоглащающего слоя. При прохождении света через окрашенный раствор некоторое количество световой энергии поглащается, вследствие чего интенсивность луча, падающего на раствор, всегда отличается от интенсивности луча, выходящего из раствора. Прохождение света через раствор подчиняется определенной закономерности (закон Ламберта-Бера).
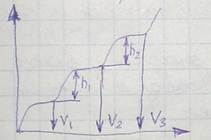

Оптическая плотность находится в зависимости от концентрации.
7) Спектральный анализ — качественное и количественное определение вещества, проводимое по его спектрам. В практике распространены атомно-эмиссионный и атомно-адсорбционный методы.
Атомно-эмиссионный метод. Эмиссия — излучение (испускание) квантов энергии в достаточно широком диапазоне при возбуждении атомов вещества под действием возбуждающих факторов. В невозбужденном состоянии атомы обладают минимальной энергией (нормальной); при возбуждении атома (воздействием высокой температурой или быстрых частиц) происходит перемещение электронов с внешних уровней на незаполненные более высокие энергетические уровни. В возбужденном состоянии атом не может находиться долго (не более чем 10^(-8) с), он стремится отдать полученную энергию (вернуться в невозбужденное состояние). При переходе электрона с верхнего уровня на нижний выделяется фотон или квант излучения определенной частоты (определенная длина волны). Излучение какой-либо одной длины волны, соответствующее определенному энергетическому переходу, называется спектральной линией. Если к атому приложить энергию больше потенциала возбуждения (то есть слишком дохуя энергии), может произойти полное удаление электрона (иначе, ионизация атома). Потенциал ионизации, да.
Типы спектров в эмиссионном анализе: сплошные, линейчатые и полосатые. Сплошной спектр содержит все длины волн в определенном интервале (радуга, например). Линейчатый спектр состоит из набора линиий со строго определенными длинами волн. Полосатый спектр — отдельные линии, расположенные близко друг к другу полосами.
Спектры возбужденных атомов — в основном, линейчатые. Возможны комбинации спектров. Наиболее яркой в спектре будет линия, соответствующая переходу с первого возбужденного уровня на основной (резонансная линия). Резонансная линия позволяет судить о качественном составе вещества.
При возвращении атома на исходный уровень часть квантов может быть поглощена свободными невозбужденными атомами (эффект самопоглащения). Самопоглащение находится в зависимости от концентрации по уравнению Ломакину (основное уравнение для количественного анализа):
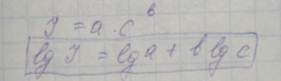
Атомно-эмиссионный спектральный анализ — основной метод экспрессного и маркировочного анализа в металлургическом производстве. Достоинства: простота проведения, экспрессность, многоэлементность, компьютеризация процесса, простота передачи результатов в АСУ ТП, возможность полной автоматизации, высокая производительность, возможность проведения различных видов анализа. Недостатки: очень высокая сложность и стоимость приборов, большое количество вспомогательных устройств, высокие требования к качеству проб и их подготовке, высокие требования к персоналу.
К приборам, в основу которых положен АЭМ: квантометры, спектрофотометры, стилоскопы.
Основные узлы атомно-эмиссионных спектральных приборов: источник возбуждения, диспергирующий элемент, приемник света, оптическая система.
Источники возбуждения:
1) пламя (возбуждение спектров в пламени имеет термический характер);
2) дуга (электрический разряд, возникающий при достаточно большом токе 5-7 А и большом напряжении 50-80 В; разряд пропускают, допустим, между электродами из анализируемого вещества; температура дуги — 5000-6000 градусов) — в дуге можно получить спектр практически всех элементов, но в результате происходит разрушение анализируемого образца, а также необходимо регулировать дугу;
3) искра (получают в искровых генераторах при температуре 1200 градусов) — метод позволяет проводить микроискровой анализ поверхности металла (электроды используют игольчатые из тугоплавких металлов, расстояние от образца до электрода — минимальное), необходимо оптическое оснащение, искра не вызывает разрушение образца, и разряд стабилен.
Диспергирующие элементы — призма и дифракционная решетка — разлагают излучение в спектр.
1) призма (использование основано на дисперсии — зависимости показателя преломления от длины волны излучения);
2) дифракционная решетка (возникает за счет системы тонких штрихов, нанесенных специальным способом на отшлифованную зеркальную поверхность).
Разрешающая способность прибора:
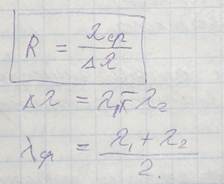
Разрешающая способность призмы нелинейна (наибольшая в коротковолновой части спектра) и зависит от материала и размеров призмы. Разрешающая способность дифракционной решетки зависит от числа штрихов и практически не зависит от длины волны.
Приемники света:
1) фотопластина (стеклянная пластинка, поверхность которой покрыта галогенидом серебра);
2) фотоэлемент (преобразует световую энергию в электрическую) — различают фотоэлемент с внешним эффектом и фотоумножитель (усиление в 10^6 раз).
Оптическая система — предназначена для получения параллельного пучка света, его фокусировки и изменения направления движения лучей.
Стилоскоп — спектральный прибор для качественного и полуколичественного анализа с визуальной регистрацией спектра. Диспергирующая система — кварцевая призма. Источник возбуждения — дуга переменного тока. Мощность генератор порядка 1 кВт. Оптический диапазон — видимая часть спектра. Изготавливается в стационарном варианте (СЛ) и переносном (СЛП). Для визуального количественного анализа используется появление в объективе соответствующих линий спектров в зависимости от концентрации анализируемого вещества. СЛП используется широко в металлургии для разбраковки металлолома и определения марок отставших слитков, позволяет проводить определение непосредственно в цехе.
Принципиальная схема СЛ-11:
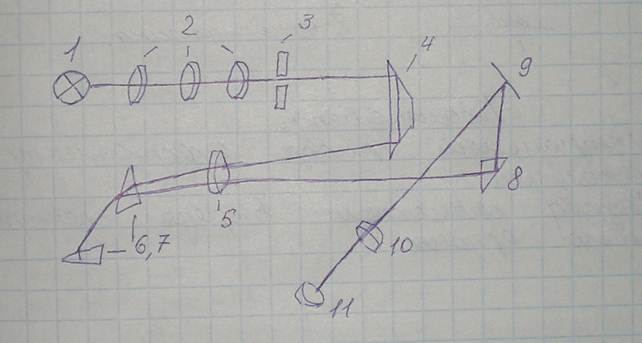
1 — свет от источника возбуждения; 2 — оптическая система. Свет через 2 попадает на входную щель 3 постоянной ширины 0,02 мм; затем поворотной призмой 4 через объектив 5 направляется на диспергирующую систему из двух призм 6-7. Покрытый серебром катет призмы 7 отражает лучи, которые вновь проходят через диспергирующую систему и через объектив 5 и поворотную призму 8 попадают на зеркало 9, затем — в окуляр 11, служащий для наблюдения спектра. Фотометрический клин 10 позволяет ослаблять интенсивность выбранной спектральной линии, и по специальной шкале, связанной с клином, можно оценивать ее относительную интенсивность. Призма 7 может вращаться, и это приводит к перемещению спектров в поле зрения (угол поворота призмы показывает, к какой части длин волн относится наблюдаемый участок). СЛ-11 предназначен для работы в области от 390-700 нм.
Спектрограф — спектральный прибор для качественного и количественного анализа с регистрацией спектра на фотопластинке с последующей расшифровкой на микрофотометре. Оптический диапазон — 300-900 нм. Диспергирующая система — кварцевая призма. Источник возбуждения — дуга или высоковольтная искра. Мощность генератора — 2-3 кВт. Для расшифровки спектров используют атласы спектральных линий и встроенную в спектрограф мм-шкалу. В металлургии широко использовали спектрографы ИСП-22, ИСП-28, ИСП-30.
Принципиальная оптическая схема ИСП-28:
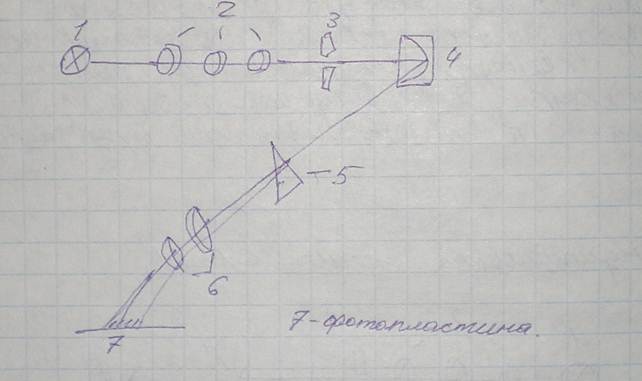
От источника возбуждения 1 свет проходит через оптическую систему 2 и через щель 3 попадает на зеркальный объектив 4, который отражает падающие лучи на диспергирующую призму 5, затем — через систему объективов 6 на фотопластину 7. Расшифровка с помощью спектропроекторов.
Квантометр — спектральный прибор с фотоэлектрической регистрацией спектра (плюс автоматическое компьютерное управление). Диспергирующая система — дифракционная решетка очень высокого разрешения. Источник возбуждения — высокочастотная конденсированная искра от отдельного генератора (до 10 кВт). Разряд происходит в среде спектрально чистого аргона.
Принципиальная схема квантометра:
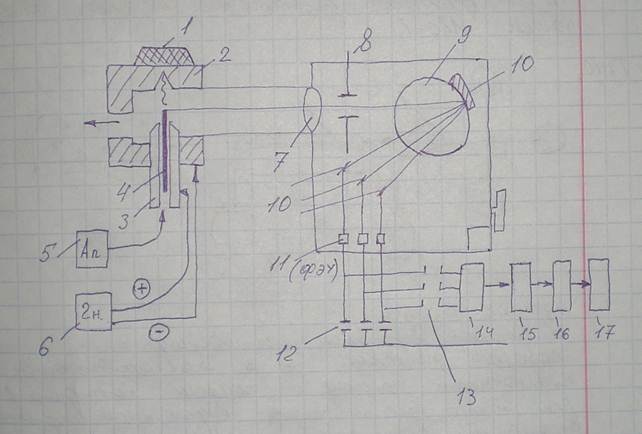
1 — образец; 2 — штатив. Образец устанавливается на штативе. Рабочий электрод 3 устанавливают так, чтобы его вольфрамовый стержень 4 был максимально приближен к образцу 1. Роль второго электрода выполняет штатив 2. Перед включением генератора 6 в систему электродов подается чистый сухой аргон из системы подготовки 5. Продувка аргоном продолжается 7 секунд (необходимо для удаления кислорода из приэлектродного пространства, так как кислород может поглощать серу, фосфор, углерод). После включения генератора дуга горит порядка 10 секунд (половина — подготовка, половина — списывание информации). Свет от излучения по направляющему каналу поступает на линзу 7 и через входную щель 8 направляется на дифракционную решетку 10, установленную в круге Роланда 9. Дифракционная решетка расщепляет пучок света в спектр и направляет его на поворотные зеркала 10’, далее спектры определяемых элементов поступают на фотоэлектрические умножители 11. Преобразованные в электрический ток и усиленные сигналы (свои для каждого элемента) поступают в накопительные конденсаторы 12, затем — на опрашивающее рэле 13, где проводится опрос по каждому элементу по очереди. Сигнал поступает на компьютерную систему обработки результатов 14, на дисплей 15, на цифропечатное устройство 16, в АСУ ТП 17 (и наконец — в самый ад). Спектр прибора — 200-400 нм. Приборы штучные, под заказ. На квантометре определяютя практически все элементы.
Атомно-абсорбционный метод анализа — основан на поглощении возбужденными атомами анализируемого вещества излучения специальной лампы с полным катодом (катод такой лампы из такого же анализируемого вещества). Роль источника света играют возбужденные атомы анализируемого материала. Далее происходит классический эмиссионный анализ. При поглощении кванта света невозбужденный атом переходит в возбужденное состояние.
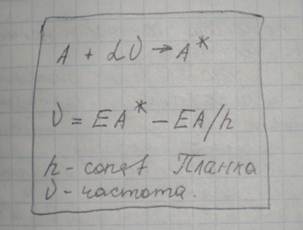
[19 декабря — зачет]
В металлургической практике достаточно широкое применение нашел ААС-1:
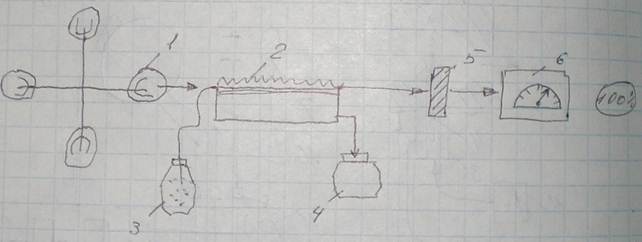
Зажигается ацителиновая горелка 2, испытуемый раствор подается из емкости 3, и он сжигается, атомы переходят в возбужденное состояние. Включается лампа с полным катодом 1. Спектр катода проходит через все элементы испытуемого раствора, при этом излучение катода будет поглощаться атомами определяемого элемента, что сразу зафиксирует фотоэлемент 5. Измерительный прибор 6 покажет его процентное содержание. Если определяемого элемента в пробе нет, весь спектр пройдет на фотоэлемент, и измерительная система покажет 100% выхода.
Рентгено-спектральный флюоресцентный метод анализа — точное определение элементов в материалах любого агрегатного состояния. Проба облучается пучком рентгеновских лучей или бомбардируется потоком электронов. Это возбуждает возбуждение характеристических линий элементов, составляющих данную пробу. Разлагая это излучение в спектр и регистрируя интенсивность отдельных линий, можно с высокой точностью провести качественный и полуколичественный анализ. Преимущества метода: высокая точность при определении больших содержаний элемента, результат анализа практически не зависит от вида соединений, в которых находится определяемый элемент, меньшая ошибка, вызванная неоднородностью распределения элемента в пробе. Недостаток: по чувствительности анализ значительно уступает оптическому. В металлургии применяется для экспрессного и маркировочного анализа (достаточно широко). Источником возбуждения используется рентгеновская трубка. В качестве детекторов и приемников излучения применяют счетчики Гейгера Мюллера.
Принципиальная схема прибора для рентгено-спектрального анализа:
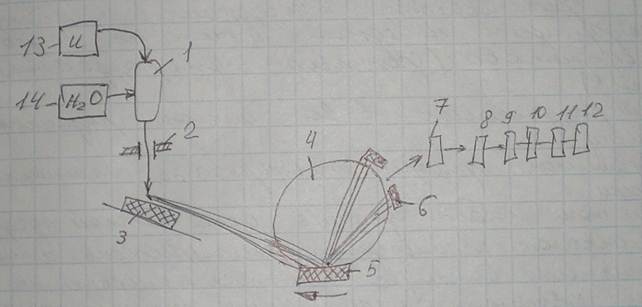
Поток рентгеновского излучения от трубки 1 через входной калиматр 2 подается на испытуемый образец 3. Полученные характеристические лучи (рентгеновские кванты) направляются на кристалл-анализатор 5 (аналог дифракционной решетки). Путем поворота кристалла выбираются интересующие длины волн и направляются на выходной калиматр 6, детектор 7, на систему компьютерной обработки 8-9, на дисплей 10, на цифропечатное устройство 11 и на АСУ ТП 12. 13 — источник. 14 — система подачи воды на охлаждение лампы. Идет сканирование сразу всех элементов, входящих в проволоку, и компьютер сразу дает общий спектр. Точность — не более 0,01%, зато обнаружение — 100% состава.
Хроматографический метод анализа — очень широко распространен благодаря удобству, простоте и большой эффективности. Метод позволяет разделять сложные смеси на компоненты, определять идентичность и однородность химических соединений, проводить количественное определение одного или нескольких компонентов в сложной смеси, определять молекулярную структуру, получать чистые вещества. Хроматографический метод настолько надежен, что вещество может считаться однородным, если не удается разделить его данным методом.
В основу метода положено разделение смеси на составляющие ее компоненты с последующим выделением их и определением их концентрации. Физическая основа метода: разделение смеси осуществляется в результате сорбции. Сорбция — процесс поглащения газов и жидкостей телами. Различают адсорбцию (на поверхности твердых тел) и абсорбцию (сорбция вещества жидкими телами). Сорбент — тело, обладающее сорбционными свойствами, сорбат — сорбируемое вещество. На поверхности сорбентов действуют силовое поле; молекулы веществ, попадая в поле, притягиваются к поверхности сорбента и образуют на ней мономолекулярный слой. Сорбируемость различных веществ на одном и том же сорбенте неодинакова — одни сорбируются легче, другие труднее (сродство). Сродство используется для сорбционного разделения смеси. Если разделяемые вещества имеют различную окраску, то на белом сорбенте будут образовываться слои разной окраски. Современные измерительные приборы позволяют анализировать вещества, не имеющие характерной окраски (бесцветные). Для того, чтобы сделать хроматограмму по зонам наиболее четкой, адсорбент после окончания всего процесса разделения промывают (используют растворитель, имеющий активность большую, чем все компоненты смеси). В результате каждая зона сдвигается, и между зонами образуется некоторый разрыв (проявление хроматограммы). При достаточно большом количестве раствора слои сорбированных веществ вымываются совсем, и на выходе из слоя получается струя растворителя, как бы послойно содержащяя все вещества анализируемой смеси; их зонные концентрации в растворителе могут служить мерой концентрацией веществ в смеси (в этом вся суть и смысл хроматографии).
Принципиальная схема колончатого хроматографа:
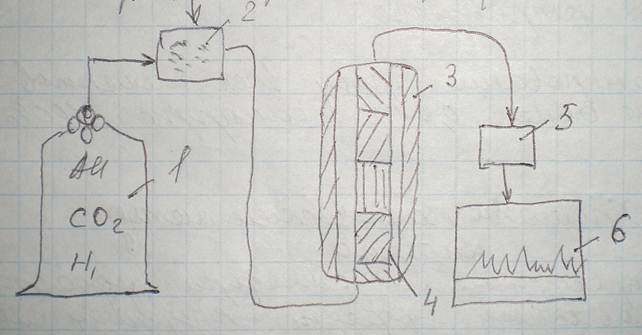
2 — впрыскивается проба, 3 — колонка.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1049; Нарушение авторских прав?; Мы поможем в написании вашей работы!