
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 14-15
|
|
|
|
Хроматографический анализ
План:
Понятие хроматографии
Процессы адсорбции и десорбции
Классификация хроматографических методов анализа (ХМА)
1. Знаменитый русский физиолог и биохимик М.С. Цвет в 1903 г. открыл новый метод разделения смесей и назвал его хроматографией.
В широком понимании хроматография – разделение в динамических условиях двух- и многокомпонентных смесей паров, газов, жидостей или растворенных веществ методом сорбции.
Обычно при прохождении потока смеси через колонку с зерненым сорбентом, происходит его разделение. В биологии и агропромышленной сфере хроматографический анализ и концентрирование используют перед количественным определением микроэлементов, а также для распознования пестицидных соединений в окружающей среде.
2. Сорбцией называют любой процесс поглощения одного вещества (сорбтива) другим (сорбентом), независимо от механизма поглощения. В зависимости от механизма сорбции различают адсорбцию, абсорбцию, хемосорбцию и капиллярную конденсацию.
Адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Если поглощение происходит во всем объеме сорбента, то его называют абсорбцией. Примером является растворение газов в жидкостях.
Поглощение одного вещества другим, сопровождающееся химическими реакциями, называют хемосорбцией.
Капиллярная конденсация состоит в ожижении паров в микропористых сорбентах.
При постоянной температуре при увеличении концентрации растворов или давления газа повышается адсорбция. Эту зависимость называют изотермой адсорбции и выражают уравнением Лэнгмюра:
(14.1)
где n - количество вещества в состоянии адсорбционного равновесия;
|
|
|
n∞ - максимальное количество адсорбируемого вещества в данном адсорбенте;
b – постоянная;
с – концентрация

Рис. 14.1. Изотерма адсорбции
В области малых концентраций изотерма линейная. На самом деле, когда bc1, знаменатель уравнения (14.1) становится равным единице и тогда уравнение принимает вид:
n = n∞, bc = ГС (14. 2).
Это – уравнение линейной адсорбции, его называют уравнением Генри. При высокой концентрации bc >1 уравнение (14.2) примет вид: n = n∞. Это называют случаем насыщения. При таком случае изотерма становится параллельной оси абсцисс. Однако в большинстве случаев изотерма адсорбции отлична от рис. 14.1. Изотерма может быть вогнутой или S - образной. Этот случай связан с тем, что на поверхности адсорбента может образоваться немономолекулярный слой.
3. Хроматографический метод анализа классифицируют так: по агрегатному состоянию среды, в котором происходит разделение смеси на компоненты; по механизму (химизму) процесса разделения; по виду (технике или прибору) проведения процесса хроматографического анализа.
По агрегатному состоянию среды для разделения смеси ХМА делят на газовые, жидкостные и газо- жидкостные.
По механизму разделения смесей хроматографию делят на адсорбционную, ионообменную, распределительную, осадительную и лигандообменную.
По механизму прохождения хроматографического процесса делят на колоночную, капиллярную и поверхностную (бумажная и тонкослойная).
Отдельно стоит ионная и жидкостная хроматография.
По методу получения хроматограмм ХМА делят на фронтальные, заместительные и элюэнтные анализы.
Для ХМА необходимо очень малое количество вещества – десятые доли миллиграмма, иногда микрограммы. Преимущество ХМА перед другими методами заключается в том, что при его использовании нет необходимости химических превращений вещества.
Фронтальный метод. Это самый простой метод. Для применения этого метода через колонку с адсорбентом непрерывно пропускают анализируемую смесь, например, компоненты А и В в растворителе Solv. Определяют концентрацию каждого компонента в растворе, вытекаемом из колонки и строят график зависимости в координатах концентрация вещества – объем раствора, проходимую через колонку. Такую зависимость и называют хроматограммой (рис. 14.2).
|
|
|
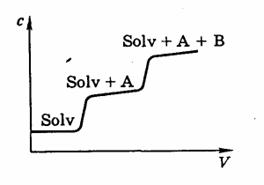
Рис. 14.2. Хроматограмма фронтального анализа
За счет сорбции веществ А и В сначала вытекает растворитель Solv, затем растворитель и малосорбирующееся вещество А, только после компонент В.
Проявительный (элюэнтный) метод. В этом методе смесь, содержащую компоненты в виде раствора или газа подают в колонку при непрерывной подаче струи газа или растворителя Solv. Тогда хорошо адсорбируемое вещество В располагается наверху колонки, а плохо адсорбируемое вещество – внизу. Это явление показано на рис. 14.3. В газовом веществе или растворе сначала появляется вещество А, затем чистый растворитель, в конце вещество В. Чем больше концентрация компонента, тем выше вершина и шире площадь кривой. Это и является основой количественного хромотографического анализа.
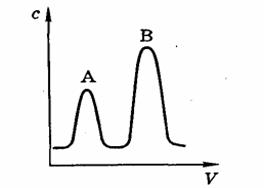
Рис. 14.3. Хроматограмма проявительного метода
Заместительный метод. При этом методе вещество А и В, находящееся в растворите Solv располагают в колонку и омывают вещество Д (заместителем). Вещество Д по сравнению с другими должно быть хорошо адсорбирующим веществом.
Контрольные вопросы и задания:
1. В чем суть хроматографического анализа?
2. Что такое сорбция и десорбция?
3. В чем отличие адсорбции, абсорбции, хемосорбции и капиллярной конденсации?
4. Изотерма адсорбции и уравнение Лэнгмюра
5. Классификация ХМА по агрегатному состоянию среды, по механизму разделения смеси, по механизму прохождения хроматографического процесса, по методу получения хроматограмм
6. Вопросы для итогового контроля
7. Общая характеристика ФХМА. Особенности ФХМА
8. Применение ФХМА в агрохимическом анализе растений
9. Применение ФХМА в агрохимическом анализе почв
10. Применение ФХМА в агрохимическом анализе удобрений
11. Основные ФХМА
12. Правильность анализа. Характеристика погрешностей
13. Статобработка результатов анализа. Критерий Стюдента
|
|
|
14. Стандартное отклонение
15. Оптические методы анализа. Классификация методов
16. Атомная спектроскопия
17. Молекулярная спектроскопия
18. Абсорбционная спектроскопия
19. Закон Бугера-Ламберта-Бера
20. Фотометрический и фотоэлектрический методы
21. Калибровочный график
22. Основные узлы приборов абсорбционной спектроскопии
23. Источники света
24. Рефрактометрический анализ
25. Относительный и абсолютный показатели преломления
26. Предельный угол
27. Принципиальная схема измерительного устройства рефрактометра
28. Поляриметрический анализ
29. Оптически активные и оптически неактивные вещества
30. Рацематы
31. Принципиальная схема поляриметра
32. Эмиссионный спектральный анализ
33. Линейчатые, полосатые и непрерывные спектры
34. Длина, частота волны и волновое число
35. Теоретические основы эмиссионного спектрального анализа
36. Постоянная Ридберга
37. Термы в спектральном анализе
38. Резонансный потенциал
39. Уравнение Ломакина-Шайбе
40. Атомно-абсорбционный анализ. Теоретические основы
41. Основные узлы приборов для атомно-абсорбционного анализа
42. Практическое применение и характеристика метода
43. Спектроскопические метод и приборы для массовых агрохимических анализов. Нейтронно-активационный анализ (НАА)
44. Основные этапы НАА
45. Кондуктометрические методы
46. Удельная и молярная электрическая проводимости
47. Мостик Уитсона
48. Высокочастотное титрование
49. Потенциометрический анализ
50. Понятие активности
51. Уравнение Нернста
52. Прямая потенциометрия. pH-растворов
53. Электрохимические и полярографические методы анализа. Теория методов
54. Электрогравиметрический анализ
55. Кулонометрия
56. Полярография
57. Количественный полярографичекий анализ
58. Хроматографический анализ
59. Процессы адсорбции и десорбции. Уравнение Лэнгмюра
60. Хемосорбция и капиллярная конденсация
61. Классификация хроматографических методов анализа
62. Газовая, жидкостная и газо-жидкостная хроматография
63. Адсорбционная, ионообменная, распределительная, осадительная хроматография
64. Колоночная, капиллярная и поверхностная (бумажная и тонкослойная) хроматография
65. Фронтальная хроматография
66. Заместительная хроматография
67. Проявительная (элюэнтная) хроматография
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 377; Нарушение авторских прав?; Мы поможем в написании вашей работы!