
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодическая система Менделеева
|
|
|
|
Принцип Паули, в его простейшей формулировке для электронов: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и ms, т. е.
Два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной.
Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
главного п (п= 1, 2, 3,...),
орбитального l (l = 0, 1, 2,..., n – 1),
магнитного ml (ml = – l,..., – 1, 0, +1, …, + l)/
магнитного спинового тs, (тs= – ½, +½).
Z (n, l, ml, ms) = 0 или 1
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно принципу, данному п соответствует п2 различных состояний электронов, отличающихся значениями l и тl. Квантовое число ms, может принимать лишь два значения (±1/2). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
 .
.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до п – 1, число подоболочек равно порядковому номеру п оболочки (см. рис. 8). Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в под оболочке с данным l равно 2 (2 l + 1).
|
|
|
Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в табл. 1 и 2.
Таблица 1
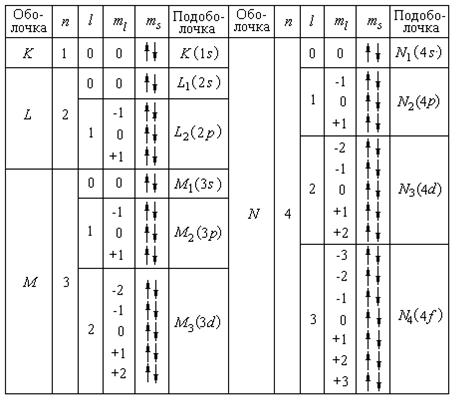
Таблица 2
| Главное квантовое число п | |||||||||||||||
| Символ оболочки | К | L | M | N | O | ||||||||||
| Максимальное число электронов в оболочке | |||||||||||||||
| Орбитальное квантовое число l | |||||||||||||||
| Символ подоболочки | 1 s | 2 s | 2р | 3 s | Зр | З d | 4 s | 4р | 4 d | 4 f | 5 s | 5 р | 5 d | 5 f | 5 g |
| Максимальное число электронов в подоболочке |
Принцип Паули, лежащий в основе систематики заполнения электронных состояний в атомах, позволяет объяснить Периодическую систему элементов Д. И. Менделеева (1869) – фундаментального закона природы, являющегося основой современной химии, атомной и ядерной физики.
Д. И. Менделеев ввел понятие порядкового номера Z химического элемента, равного числу протонов в ядре и соответственно общему числу электронов в электронной оболочке атома. Расположив химические элементы по мере возрастания порядковых номеров, он получил периодичность в изменении химических свойств элементов. Однако для известных в то время 64 химических элементов некоторые клетки таблицы оказались незаполненными, так как соответствующие им элементы (например, Gа, Sе, Gе) тогда еще не были известны. Д. И. Менделеев, таким образом, не только правильно расположил известные элементы, но и предсказал существование новых, еще не открытых, элементов и их основные свойства. Кроме того, Д. И. Менделееву удалось уточнить атомные веса некоторых элементов. Например, атомные веса Ве и U, вычисленные на основе таблицы Менделеева, оказались правильными, а полученные ранее экспериментально — ошибочными.
Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для объяснения таблицы будем считать, что каждый последующий. элемент образован из предыдущего. прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома. Взаимодействием электронов пренебрегаем, внося, где это необходимо, соответствующие поправки. Рассмотрим атомы химических элементов, находящиеся в основном состоянии.
|
|
|
Единственный электрон атома водорода находится в состоянии 1 s, характеризуемом квантовыми числами n =1, l = 0, ml = 0 и ms = ± ½ (ориентация его спина произвольна). Оба электрона атома Не находятся в состоянии 1 s, но с антипараллельной ориентацией спина. Электронная конфигурация для атома Не записывается как 1s2 (два 1 s -электрона). На атоме Не заканчивается заполнение К-оболочки, что соответствует завершению I периода Периодической системы элементов Менделеева (табл.3).
Третий электрон атома Li (Z = 3), согласно принципу Паули, уже не может разместиться в целиком заполненной К-оболочке и занимает наинизшее энергетическое состояние с n = 2 (L -оболочка), т. е. 2 s -состояние. Электронная конфигурация для атома Li: 1 s2 2 s. Атомом Li начинается II период Периодической системы элементов. Четвертым электроном Ве (Z =4) заканчивается заполнение подоболочки 2 s. У следующих шести элементов от В (Z = 5) до Ne (Z = 10) идет заполнение подоболочки 2 р (табл. 2). II период Периодической системы заканчивается неоном – инертным газом, для которого подоболочка 2 р полностью заполнена.
Одиннадцатый электрон Na (Z =11) размещается в М -оболочке (n = 3), занимая наинизшее состояние 3 s. Электронная конфигурация имеет вид 1 s2 2 s2 2 р6 3 s. З s -электрон (как и 2 s электрон Li ) является валентным электроном, поэтому оптические свойства Nа подобны свойствам Li. С Z =12 идет последовательное заполнение М-оболочки. Ar (Z = 18) оказывается подобным Не и Nе: в его наружной оболочке все s - и р -состояния заполнены. Аг является химически инертным и завершает 111 период Периодической системы.
Таблица 3
| Период | І | ІІ | ІІІ | |||
| Z | 1 2 | 3 4 5 6 7 8 9 10 | 11 12 13 14 15 16 17 18 | |||
| Элемент | H He | Li Be B C N O F Ne | Na Mr Al Si P S Cl Ar | |||
| K | 1 s | 1 2 | 2 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | ||
| L | 2 s | 1 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | |||
| 2 p | 1 2 3 4 5 6 | 6 6 6 6 6 6 6 6 | ||||
| M | 3 s | 1 2 2 2 2 2 2 2 | ||||
| 3 p | 1 2 3 4 5 6 | |||||
| 3 d | ||||||
| N | 4 s | |||||
| 4 p | ||||||
| 4 d | ||||||
| 4 f | ||||||
| Период | ІѴ | |||||
| Z | 19 20 21 22 23 24 25 26 27 28 | 29 30 31 32 33 34 35 36 | ||||
| Элемент | K Ca Sc Ti V Cr Mg Fe Co Ni | Cu Zn Ga Ge As Se Br Kr | ||||
| K | 1 s | 2 2 2 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | |||
| L | 2 s | 2 2 2 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | |||
| 2 p | 6 6 6 6 6 6 6 6 6 6 | 6 6 6 6 6 6 6 6 | ||||
| M | 3 s | 2 2 2 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | |||
| 3 p | 6 6 6 6 6 6 6 6 6 6 | 6 6 6 6 6 6 6 6 | ||||
| 3 d | – – 1 2 3 5 5 6 7 8 | 10 10 10 10 10 10 10 10 | ||||
| N | 4 s | 1 2 2 2 2 1 2 2 2 2 | 1 2 2 2 2 2 2 2 | |||
| 4 p | 1 2 3 4 5 6 | |||||
| 4 d | ||||||
| 4 f | ||||||
|
|
|
Девятнадцатый электрон К (Z = 19) должен был бы занять З d -состояyие в М -оболочке. Однако и в оптическом, и в химическом отношениях атом К схож с атомами Li и Na, которые имеют внешний валентный электрон в s -состоянии. Поэтому 19-й валентный электрон К должен также находиться в s -состоянии, но это может быть только s -состояние новой оболочки (N -оболочки), т.е. заполнение N -оболочки для К начинается при незаполненной М -оболочке. Это означает, что в результате взаимодействия электронов состояние n =4, l =0 имеет меньшую энергию, чем состояние n = 3, l = 2. Спектроскопические и химические свойства Са (Z = 20) показывают, что его 20-й электрон также находится в 4 s- состоянии N -оболочки. В последующих элементах происходит заполнение М оболочки (от Sс (Z = 21) до Zn (Z = 30)). Далее N -оболочка заполняется до Кг(Z = 36), у которого опять-таки, как и в случае Ne и Aг, s - и p -состояния наружной оболочки заполнены полностью. Криптоном заканчивается IV период Периодической системы.
Подобные рассуждения применимы и к остальным элементам таблицы Менделеева, однако эти данные можно найти в справочниках. Отметим лишь, что и начальные элементы последующих периодов являются щелочными металлами, а их последний электрон находится в s- состоянии. Кроме того, атомы инертных газов (Не, Ne, Аг, Кг, Хе, Rn) занимают в таблице особое положение – в каждом из них s- и p- состояния наружной оболочки полностью заполнены и ими завершаются очередные периоды Периодической системы.
|
|
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 366; Нарушение авторских прав?; Мы поможем в написании вашей работы!