
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение мономолекулярной адсорбции Ленгмюра
|
|
|
|
Теория Ленгмюра является фундаментальным вкладом в учение об адсорбции. Она дает возможность учесть наиболее сильные отклонения от закона Генри, связанные с ограниченностью адсорбционного объема и поверхности адсорбента. Такая ограниченность приводит к насыщенному поверхности адсорбента по мере увеличения концентрации распределяемого веществе. Это положение является основным в теории Ленгмюра и уточняется следующими допущениями:
1) Адсорбция локализована (молекулы не перемещаются по поверхности) на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата – образуется мономолекулярный слой;
2) адсорбционные центры энергетически эквивалентны – поверхность адсорбента эквипотенциальна;
3) адсорбированные молекулы не взаимодействуют друг с другом.
Для получения изотермы адсорбции обратимся к основному положению теории Ленгмюра. Предположим, что происходит квазихимическая реакция между распределяемыми компонентами и адсорбционными центрами молекул

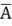 - адсорбционные центры поверхности
- адсорбционные центры поверхности
 – распределяемое вещество
– распределяемое вещество
 – образующийся на поверхности комплекс.
– образующийся на поверхности комплекс.
По мере увеличения концентрации вещества В реакция сдвигается в сторону образования комплекса и свободных адсорбционных центров становится меньше. Константа адсорбционного равновесия (без учета коэффициентов реагирующих веществ)

В этом соотношении

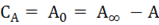 (б)
(б)
где: А- величина адсорбции;
А∞ - емкость адсорбционного монослоя (число адсорбционных центров, приходящихся на единицу площади поверхности или на единицу массы адсорбента);
А0 – число оставшихся свободных адсорбционных центров, приходящихся на единицу поверхности или единицу массы адсорбента.
|
|
|
Подставим (б) в (а) и получим
 или А=
или А=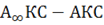
А= – это выражение называется уравнением изотермы Ленгмюра.
– это выражение называется уравнением изотермы Ленгмюра.
Для адсорбции газов и паров это уравнение принимает вид:
А=
Константа адсорбционного равновесия «К» и «Кр» характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее взаимодействие, тем больше константа адсорбционного равновесия.
Адсорбционное уравнение Ленгмюра можно представить относительно степени заполнения поверхности-отношения величины адсорбции «А» к емкости монослоя «А∞».

Если
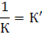 тогда
тогда
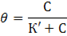
Изотерма адсорбции Ленгмюра имеет вид



 А
А
 |
А∞
С (Р)
Физическая адсорбция протекает почти мгновенно (до 10-12 – 10-6c), продолжительность процесса хемосорбции значительно больше (>102 c).
Представим схематически единицу площади, (например 1 м2) адсорбционного слоя н границе раздела фаз.
Молекула адсорбата занимает в поверхностном слое площади S0, число его молекул n, тогда площадь nS0 – это площадь, которая приходится на все молекулы адсорбата в расчете на единицу площади адсорбционного слоя.
Поверхность, свободная от молекул адсорбата равна (1- nS0). Свободная поверхность определяет возможность последующего протекания адсорбции.
Скорость адсорбции Vа (т.е скорость перехода молекул из объема в поверхностный слой) пропорциональна концентрации вещества в объеме «С» и свободной площади
Vа = СКа (1- nS0). (1)
Динамический процесс адсорбции предполагает процесс десорбции части вещества из адсорбционного слоя площади nS0.
Скорость десорбции Vд пропорциональна этой площади и определяется по уравнению
Vд = Кд (nS0). (2)
При условии равновесия скорости прямого и обратного процесса равны. Тогда константа равновесия
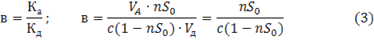
Выразим количество молекул адсорбента:
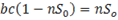


В случае предельной адсорбции вся площадь раздела занята молекулами адсорбента.
|
|
|
По отношению к выбранной единице площади это можно выразить:
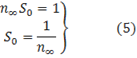
где  - число молекул в насыщенном адсорбционном слое.
- число молекул в насыщенном адсорбционном слое.
Ненасыщенный адсорбционный слой не полностью занят молекулами адсорбента.
Степень насыщения адсорбционного слоя можно выразить:
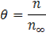
Число молекул в ненасыщенном 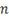 и насыщенном
и насыщенном 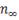 можно выразить через адсорбцию:
можно выразить через адсорбцию:

NA – число Авогадро.
Подставим значение 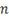 ,
,  и S0 уравнение (4), тогда
и S0 уравнение (4), тогда
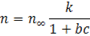

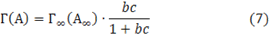
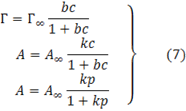
b или k – константа адсорбционного равновесия.
В соответствии с равенством (6) определялось абсолютное число молекул в адсорбционном слое, а, следовательно, абсолютная адсорбция. Но поскольку роль идет о большом избытке молекул в поверхностном слое по сравнению с их содержанием в объеме можно воспользоваться уравнением:
Г=А
Поэтому в уравнении (7) адсорбция обозначена как Г(А).
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 970; Нарушение авторских прав?; Мы поможем в написании вашей работы!