
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимия
|
|
|
|
Все химические процессы протекают либо с выделением, либо с поглощением тепла. Экзотермическими называют процессы, идущие с выделением тепла и эндотермическими – идущие с поглощением тепла. Количество выделяемой или поглощаемой теплоты называется тепловым эффектом реакции.
Для изохорных процессов тепловой эффект равен изменению внутренней энергии: 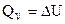 , для изобарных – изменению энтальпии:
, для изобарных – изменению энтальпии: , т. е. тепловой эффект не является функцией состояния системы, т.к. зависит от условий проведения реакции.
, т. е. тепловой эффект не является функцией состояния системы, т.к. зависит от условий проведения реакции.
Химические уравнения, в которых указан тепловой эффект реакции при постоянном давлении и температуре, называются термохимическими уравнениями. Причём, в термодинамике все процессы рассматриваются со стороны самой системы: тепловой эффект считается положительным (DН > 0) для эндотермических процессов и отрицательным (DН < 0) для экзотермических процессов.
Тепловой эффект реакции при постоянном давлении (DН) измеряется в кДж, и относится к числу молей веществ, участвующих в реакции. Кроме того, в термохимических уравнениях указывают агрегатное состояние веществ, участвующих в реакции.
Энтальпия реакции приводится для стандартных условий: температуры 298°К и давления в 1 атм. = 101325 Па.
Изменение энтальпии может быть найдено не только для химических реакций, но и для других процессов – например, фазовых переходов. Фазовым переходом называют переход одной фазы в другую: твёрдое – жидкое (испарение), твёрдое – газ (сублимация или возгонка) и т. д.
Стандартная энтальпия образования сложного вещества - это тепловой эффект реакции образования 1-го моля сложного вещества из простыхвеществ.
Стандартная энтальпия разложения сложного вещества - это тепловой эффект реакции разложения 1-го моля сложного вещества на простые вещества.
|
|
|
Стандартная энтальпия образования 1-го моля сложного вещества равна стандартной энтальпии разложения 1-го моля вещества, взятого с обратным знаком – закон Лавуазье-Лапласа.
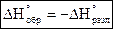 , где
, где  ,
, 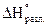 - энтальпии образования (разложения) сложного вещества при стандартных условиях.
- энтальпии образования (разложения) сложного вещества при стандартных условиях.
Энтальпия образования 1-го моля вещества приводится в таблицах и измеряется в  . Энтальпии образования простых веществ равны нулю.
. Энтальпии образования простых веществ равны нулю.
Основной закон термохимии (закон Гесса).
Тепловой эффект химической реакции не зависит от пути проведения процесса, числа и вида промежуточных стадий, а зависит только от начального и конечного состояния реагирующих веществ, при условии постоянства давления или постоянства объёма.
1-ое следствие закона Гесса. Тепловой эффект процесса равен сумме тепловых эффектов промежуточных стадий.

2-ое следствие закона Гесса. Тепловой эффект процесса равен алгебраической разности между суммой теплот образований продуктов реакции и суммой теплот образования исходных веществ, причём коэффициенты в уравнении учитываются как сомножители теплот образований.
сС + dD = аА + bВ;
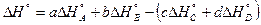 ;
;

Пример расчёта теплового эффекта химической реакции:
 ; DН =?
; DН =?
| Вещество | ΔН0298, кДж/моль |
| NH3(г) | -46,2 |
| О2(г) | |
| Н2О(ж) | -285,8 |
| NO(г) | 90,3 |
 =
=
= 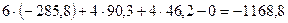 кДж.
кДж.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!